Sporing af nitrogenoxid-signalvejen
Kredit:Wiley
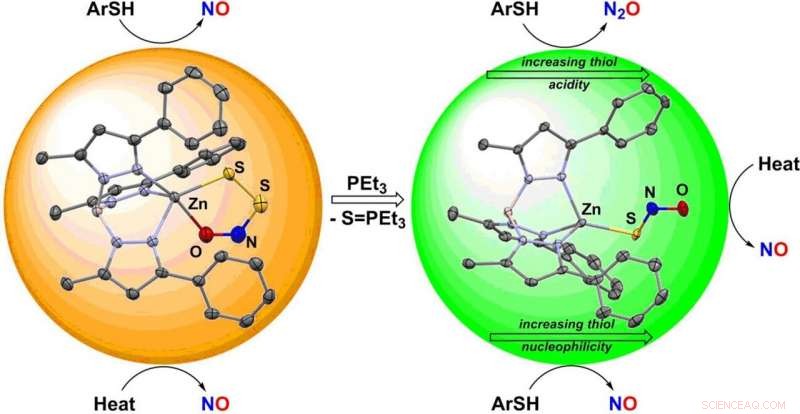
Både nitrogenoxid (NO) og svovlbrinte (H 2 S) fungerer som gasformige signalmolekyler med lignende fysiologiske virkninger. Mange af de kritiske spørgsmål om samspillet mellem disse to gasotransmittere afhænger af deres kemiske reaktivitet og den flygtige eksistens af HSNO, et nøgleprodukt af reaktionen mellem dem. Et team af forskere har været i stand til at stabilisere, isolere, og karakterisere to af de arter, der er bundet til disse signalveje gennem binding til et zinkkompleks, som rapporteret i journalen, Angewandte Chemie .
NO er et centralt signalmolekyle i biologien, der regulerer mange fysiologiske funktioner, herunder vaskulær dilatation, transmission af nerveimpulser, og cellebeskyttelse. Interessant nok, H 2 S udviser lignende virkninger, afslappende glatte muskelceller involveret i vasodilatation. HSNO kan således spille en nøglerolle i overlapningen af disse signalveje. Denne ekstremt reaktive art er så ustabil, imidlertid, at dets biokemi og diskrete reaktionsveje er meget vanskelige at bestemme. HSNO passerer let gennem cellemembraner og kan nitrosylere proteiner, overføre sin nitrosylgruppe (–N =O) til andre rester, især cystein, som repræsenterer et vigtigt skridt i en række cellulære reguleringsmekanismer. Ved biologisk pH, HSNO eksisterer sandsynligvis som thionitritanionen SNO − der er ustabil over for omdannelse til perthionitritanionen SSNO − .
Kandidatstuderende Valiallah Hosseininasab i teamet ledet af Timothy H. Warren ved Georgetown University (Washington, D.C., U.S.) stabiliserede SNO − og SSNO − anioner gennem binding til et særligt zinkkompleks inspireret af et fælles miljø for zink i biologien. Zink er et fysiologisk vigtigt metal, der er involveret i utallige processer, der inkluderer regulering af blodets pH gennem enzymet kulsyreanhydrase. I øvrigt, molekyler involveret i nitrogenoxid-signalering, såsom H 2 S- og S-nitrosothioler (molekyler med en –S–N=O-gruppe), reagerer let med zink-svovlbindinger, der danner vigtige strukturelle enheder, hvis modifikation i proteiner fører til funktionel ændring.
Georgetown-holdet afslørede, at zinkkomplekser indeholdende SNO
−
og SSNO
−
anioner kunne isoleres og karakteriseres. Undersøgelser af deres reaktivitetsmønstre viste interessante forskelle i deres reaktioner med thioler (stoffer med en sulfidgruppe,
–
SH), allestedsnærværende antioxidanter, der hjælper med at beskytte cellerne mod skader. Mens reaktioner med perthionitrit danner NO, thionitrit danner enten dinitrogenoxid (lattergas) N 2 O eller S-nitrosothioler, som repræsenterer færdige reservoirer af NO. Disse resultater tyder på, at de mindste forskelle i forløbet af fysiologiske signalveje kan føre til forskellige udgangssignaler, der i sidste ende er resultatet af samspillet mellem NO og H 2 S.
 Varme artikler
Varme artikler
-
 Hvilke elementer findes i lipider?Lipider er store organiske molekyler eller makromolekyler. På grund af deres tilknytning til diætfedt vinder lipider ikke mange popularitetskonkurrencer. Men lipider er vigtige for mere end voksend
Hvilke elementer findes i lipider?Lipider er store organiske molekyler eller makromolekyler. På grund af deres tilknytning til diætfedt vinder lipider ikke mange popularitetskonkurrencer. Men lipider er vigtige for mere end voksend -
 Hvordan robotmatematik og smartphones førte forskere til et gennembrud for stofopdagelseAt flytte en robot er som at manipulere et molekyle. Kredit:Willyam Bradberry/Shutterstock.com For os mennesker, en sund hjerne håndterer alle de små detaljer om kropslig bevægelse uden at kræve b
Hvordan robotmatematik og smartphones førte forskere til et gennembrud for stofopdagelseAt flytte en robot er som at manipulere et molekyle. Kredit:Willyam Bradberry/Shutterstock.com For os mennesker, en sund hjerne håndterer alle de små detaljer om kropslig bevægelse uden at kræve b -
 Forskere udvikler mikrobobler til at ødelægge farlige biofilmProfessor i kemisk og biomolekylær ingeniørvidenskab Simon Rogers, venstre, postdoktorale forskere Jun Pong Park og Yongbeom Seo og professor i kemisk og biomolekylær teknik Hyunjoon Kong ledede et in
Forskere udvikler mikrobobler til at ødelægge farlige biofilmProfessor i kemisk og biomolekylær ingeniørvidenskab Simon Rogers, venstre, postdoktorale forskere Jun Pong Park og Yongbeom Seo og professor i kemisk og biomolekylær teknik Hyunjoon Kong ledede et in -
 Sød lysin nedbrydningKredit:CC0 Public Domain Forskere fra afdelingerne for kemi og biologi ved universitetet i Konstanz har fået grundlæggende ny indsigt i nedbrydningen af aminosyren lysin - kræftfremkaldende onco
Sød lysin nedbrydningKredit:CC0 Public Domain Forskere fra afdelingerne for kemi og biologi ved universitetet i Konstanz har fået grundlæggende ny indsigt i nedbrydningen af aminosyren lysin - kræftfremkaldende onco
- Hvor godt er dit nytårsbobler? Lyt godt efter
- Klima og dødelighed i Kenya, Mali, og Malawi
- Et Brexit uden aftale kan skade Storbritanniens evne til at klare pandemier
- En skefuld fedt får medicinen til at gå ned
- Sådan beregnes årlige gennemsnit
- Lønforskellen mellem mænd og kvinder mindskes for nogle kvindelige universitetsformænd


