Monkey skruenøgle molekyle syltetøjer tuberkulose protein
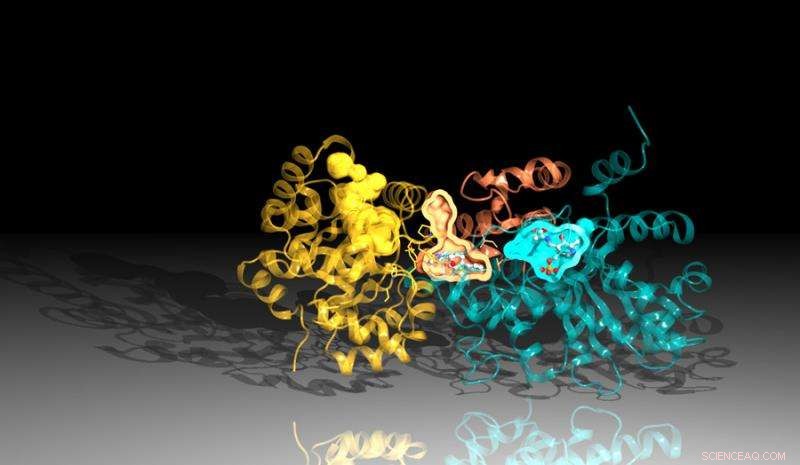
Billede af proteinet tryptophansyntase skabt ved hjælp af diffraktionsdata fra Argonnes Advanced Photon Source. Hæmmeren binder sig mellem reaktionsstederne i proteinet, repræsenteret her ved de orange og blå lommer. Kredit:Argonne National Laboratory
Tuberkulose har nu overgået HIV på verdensplan som den største dødsårsag på grund af infektionssygdomme. De bakterier, der forårsager denne sygdom, Mycobacterium tuberculosis (Mtb), udvikler hurtigt resistens over for nuværende tilgængelige antibiotika, øget presserende behov for opdagelse af nye lægemidler.
Forskere ved U.S. Department of Energys (DOE) Argonne National Laboratory var en del af en nylig opdagelse af et nyt molekyle kaldet en inhibitor, der angriber tuberkulosefremkaldende bakterier ved at afbryde produktionen af et kemikalie, der er nødvendigt for dets overlevelse.
At skabe antibiotika involverer udvikling af inhibitorer, der effektivt kan blokere essentielle bakterielle processer. Lige så vigtigt er det at blive ved med at finde nye veje til mål, så når bakterierne til sidst tilpasser sig til at modstå et antibiotikum, der er stadig andre muligheder at udnytte.
Den nye undersøgelse, et samarbejde mellem Argonne, University of Chicago og Broad Institute of Harvard og MIT, identificeret en inhibitor, der virker ved at blokere virkningen af et vigtigt protein i Mtb. Inhibitoren binder sig til en kanal i proteinet, der forbinder dets to dele, dræber bakterierne gennem et ironisk twist. Hæmmeren tvinger en del af proteinet til at producere de komponenter, der er nødvendige for at skabe et væsentligt kemikalie, tryptofan, og samtidig omforme kanalen for at opsnappe disse ingredienser, før den anden del af proteinet kan bruge dem.
Disse typer af inhibitorer, kaldet allosteriske hæmmere, ikke binder til den del af proteinet, der faktisk er ansvarlig for at producere målkemikaliet. I stedet, de fungerer som en abenøgle, der sidder fast i andre mindre tydelige dele af bakteriernes komplicerede maskineri. Inhibitoren identificeret i denne forskning, beskrevet i en nylig artikel i Nature Chemical Biology, er nu en af de mest dybt undersøgte allosteriske hæmmere til dato.
Det målrettede kemikalie, tryptofan, er et stof, der er afgørende for at give alle levende celler deres struktur og beskytte dem mod deres omgivelser. Menneskeceller skal rode tryptofan fra mad eller bakterier i tarmen, men Mtb-celler kan fremstille deres egen tryptofan ved hjælp af et komplekst protein kaldet tryptofansyntase. "Vi vidste, at en måde at dræbe disse bakterier på var at finde en måde at blokere tryptofansyntasen på, " sagde Karolina Michalska, en Argonne-krystallograf og forfatter til undersøgelsen.
Inden samarbejdet begyndte, en gruppe forskere ved Broad Institute puttede en lille mængde af bakterierne i petriskåle og anbragte forskellige potentielle inhibitorer i hver af dem. Ud af et bibliotek på over 80, 000 testede potentielle inhibitorer, kun få dræbte Mtb. Forskerne havde mistanke om, at en af disse inhibitorer lukkede ned for Mtb's tryptofansyntase, men de havde brug for at se, hvad der skete på det molekylære plan.
Argonne-forskere hørte om arbejdet på Broad Institute, og de to grupper begyndte at samarbejde. Argonne producerede tryptophansyntase til Broad Institute til brug for at teste inhibitoren. De bestemte også strukturen af syntasen med inhibitoren bundet til den ved at udsætte krystaller sammensat af protein-hæmmerkomplekset for højenergi røntgenstråler fra Argonnes Advanced Photon Source (APS) og registrere, hvordan elektronerne i molekylet spredte lyset .
"Samarbejdet gjorde det muligt for os at bestemme den allosteriske karakter af inhibitoren og nuancerne af, hvordan inhiberingen virkede, " sagde Deborah Hung, en professor ved Harvard Medical School og meddirektør for Infectious Disease and Microbiome Program ved Broad Institute.
Den strukturelle analyse fastslog, at der er to nøgledele, der udgør tryptophansyntase. Når en af regionerne signalerer til den anden, at den er klar, den anden region laver et kemisk stof kaldet indol. Indolen bevæger sig derefter gennem en kanal til den anden region af tryptofansyntasen, hvor den kombineres med et andet stof for at skabe det endelige produkt, tryptofan.
En lille ustabilitet i kanalen ville tillade indolen at rejse til den anden side, men inhibitoren er formet, så den stabiliserer kanalen, forhindrer indolen i at bevæge sig. Da indolen ikke kan nå den anden side af proteinet, hæmmeren blokerer produktionen af tryptofan.
"Det fungerer faktisk på en ret lusket måde, " sagde Andrzej Joachimiak, Direktør for Argonne's Structural Biology Center og Midwest Center for Structural Genomics. "Inhibitoren både tvinger tryptofansyntasen til at producere indolen og forhindrer den i at udføre sin ultimative pligt."
Selvom forskerne er optimistiske med hensyn til denne inhibitors potentiale som et antibiotikum, det er stadig langt fra at være et tilgængeligt lægemiddel. De har undersøgt, hvordan menneskeligt væv ville reagere på molekylet og har bekræftet, at det er ugiftigt, men forsøg med mus har vist, at inhibitoren ville blive metaboliseret for hurtigt af kroppen. Der forskes nu i at forfine inhibitorens struktur, så den forbliver i blodbanen i en længere periode.
Sidste artikelForskere studerer syntetiske proteinbure
Næste artikelForskere finder en ny teknik til at justere farven på LED-lysemission
 Varme artikler
Varme artikler
-
 Syntetisere en ny klasse af bio-inspirerede, lysfangende nanomaterialerPOSS-peptoidmolekyler samler sig selv til rombeformede nanokrystaller. Kredit:Stephanie King | Pacific Northwest National Laboratory Inspireret af naturen, forskere ved Pacific Northwest National
Syntetisere en ny klasse af bio-inspirerede, lysfangende nanomaterialerPOSS-peptoidmolekyler samler sig selv til rombeformede nanokrystaller. Kredit:Stephanie King | Pacific Northwest National Laboratory Inspireret af naturen, forskere ved Pacific Northwest National -
 Fem mærkelige og vidunderlige måder naturen bliver udnyttet til at opbygge en bæredygtig modeindu…Enzymatiske tekstilfarvestoffer. Forfatter oplyst En af de største udfordringer for tekstil- og modeindustrien er at gøre sig selv mere bæredygtig, ikke kun hvad angår økonomiske og arbejdsmæssige
Fem mærkelige og vidunderlige måder naturen bliver udnyttet til at opbygge en bæredygtig modeindu…Enzymatiske tekstilfarvestoffer. Forfatter oplyst En af de største udfordringer for tekstil- og modeindustrien er at gøre sig selv mere bæredygtig, ikke kun hvad angår økonomiske og arbejdsmæssige -
 Forskere opløser råolie i vand for at studere dens sammensætningIllustration. Olie opløst i vand. Kredit:@tsarcyanide/MIPT Forskere fra MIPT, Skoltech, Det Russiske Videnskabsakademis Fælles Institut for Høje Temperaturer, og Lomonosov Moscow State University
Forskere opløser råolie i vand for at studere dens sammensætningIllustration. Olie opløst i vand. Kredit:@tsarcyanide/MIPT Forskere fra MIPT, Skoltech, Det Russiske Videnskabsakademis Fælles Institut for Høje Temperaturer, og Lomonosov Moscow State University -
 NREL undersøger belægninger, der er nødvendige for at koncentrere solenergiForsker Judith Gomez-Vidal fastslog de belægninger, der er nødvendige for at tillade koncentrerende solenergianlæg at opbevare og bruge smeltede salte. Kredit:Dennis Schroeder, NREL 45088 Næste ge
NREL undersøger belægninger, der er nødvendige for at koncentrere solenergiForsker Judith Gomez-Vidal fastslog de belægninger, der er nødvendige for at tillade koncentrerende solenergianlæg at opbevare og bruge smeltede salte. Kredit:Dennis Schroeder, NREL 45088 Næste ge
- Nanokrystaller ikke små nok til at undgå defekter
- Hjerneundersøgelse afslører, hvordan insekter gør sig lige til hjemmet
- Sådan slår du et LED-lys til en switch
- Hyldest til vådere tider på Mars
- Taget på fersk gerning:Automatiske kameraer vil opdage mobilbrugende bilister, men til hvilken pris…
- På vej til nanotheranostics


