Skarpeste billede af Alzheimers fibriller viser hidtil ukendte detaljer

En 3-D rekonstruktion af en amyloid fibril fra to protofilamenter (rød/blå) beregnet ud fra kryo-elektronmikroskopibilleder. Kredit:Forschungszentrum Jülich / HHU Düsseldorf / Gunnar Schröder
Et team af forskere fra Tyskland og Holland har bestemt strukturen af en amyloidfibril med tidligere uopnået opløsning. Fibrillerne i kroppens eget amyloid beta (Aβ) protein er hovedbestanddelen i hjerneproteinaflejringer forbundet med Alzheimers. Den tredimensionelle struktur på atomniveau, som forskerne har belyst, afslører hidtil ukendte aspekter af væksten af skadelige aflejringer og effekten af genetiske risikofaktorer. Resultaterne er blevet offentliggjort i det anerkendte tidsskrift Videnskab .
Strukturen afslører, hvordan de mange enkelte Aβ-proteinmolekyler forskydes i lag oven på hinanden og er arrangeret i såkaldte protofilamenter. To af disse protofilamenter er tvundet rundt om hinanden for at danne en fibril. Hvis flere af disse fibriller bliver viklet ind, de giver anledning til de karakteristiske aflejringer eller plak, der påvises i hjernevævet hos Alzheimers patienter.
"Dette er en milepæl på vejen mod en grundlæggende forståelse af amyloidstrukturer og relaterede sygdomme, "siger prof. Dieter Willbold." Fibrilstrukturen besvarer mange spørgsmål om mekanismen for fibrilvækst og identificerer den rolle, som en hel række familiære mutationer spiller, der fører til tidlig debut af Alzheimers sygdom. "
Opløsningen på 4 Ångstrøm, svarende til 0,4 nanometer, er inden for den typiske størrelse af atomradier og atombindingslængder. I modsætning til tidligere arbejde, modellen viser for første gang proteinernes nøjagtige position og interaktioner. Aβ -molekylerne i de sammenfiltrede protofilamenter er således ikke på samme niveau, men som en lynlås, de er forskudt med et halvt interval. Desuden, strukturen belyser placeringen og konformationen af alle 42 aminosyrerester af de mange individuelle Aβ-proteinmolekyler for første gang.
Denne detaljerede struktur giver et nyt grundlag for at forstå den strukturelle effekt af en række genetiske modifikationer, der øger risikoen for at udvikle sygdommen. De stabiliserer fibrillerne ved at ændre proteinets plan på definerede steder. Dette forklarer også, hvorfor mus i naturen ikke udvikler Alzheimers, og hvorfor en lille del af den islandske befolkning ser ud til at være mere eller mindre resistente over for sygdommen. Deres varianter af Aβ adskiller sig med tre eller en aminosyrerester, henholdsvis, som tilsyneladende er vigtige for fibrillernes stabilitet.
Metodisk mangfoldighed på det højeste teknologiske niveau
I modsætning til de plaketter, der er typiske for sygdommen, der blev opdaget af Alois Alzheimer for mere end 100 år siden, den nu afslørede fibrilstruktur kan ikke direkte observeres under lysmikroskopet. Det tog mere end et år at analysere de data, som forskerne havde opnået ved hjælp af kryo-elektronmikroskopifaciliteten ved Maastricht Universitet. I øvrigt, målinger ved hjælp af fast-state nuklear magnetisk resonans (NMR) spektroskopi og røntgendiffraktionseksperimenter hjalp med at supplere og fuldt ud understøtte billedet af fibrilstrukturen og validere de opnåede data.
"De enkelte billeder i kryo-elektronmikroskopi er normalt ekstremt støjende, da proteiner er meget følsomme over for elektronstråling, og billederne kan kun genereres med meget lav strålingsintensitet, " forklarer Jun.-Prof. Gunnar Schröder. Ved hjælp af en computer-assisteret procedure, han kombinerede tusindvis af individuelle billeder og udtrak således højopløselige strukturelle data fra dem.
"Dette er et trin, der kan være meget kompliceret, hvis prøven består af forskelligt dannede fibriller. Tidligere har dette var næsten altid tilfældet med amyloidfibrillerne og repræsenterede en af de største forhindringer for analysen. Imidlertid, vi havde nu en ret unik prøve med meget homogene fibriller - 90 procent af dem havde samme form og symmetri, siger Schröder.
Dr. Lothar Gremer lykkedes at producere fibrilprøven. "Det afgørende skridt var i høj grad at bremse væksten af fibrillerne i prøven, fra et par timer til flere uger. Derved, de individuelle Aβ-molekyler fik tid nok til at arrangere sig selv i homogene fibriller på en meget ensartet og meget velordnet måde, siger Gremer, hvem igangsatte og koordinerede undersøgelsen.
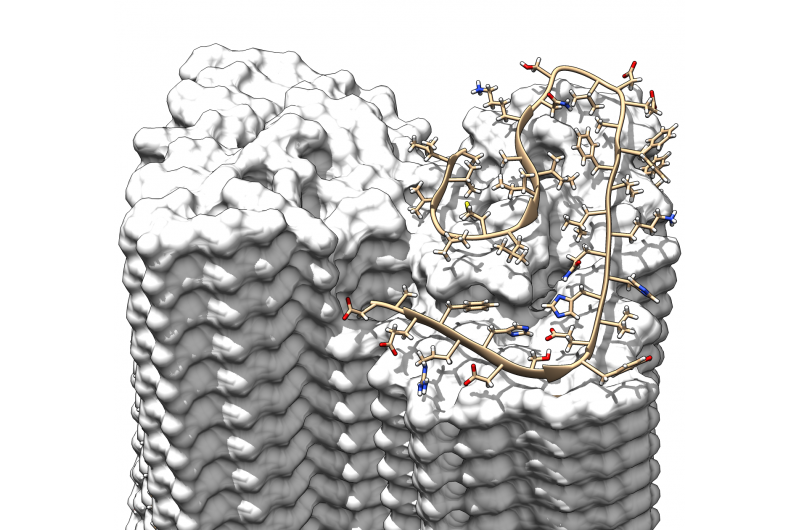
Et tværsnit gennem fibrillen, der illustrerer det trinvise overlappende arrangement af Aβ -proteiner Kredit:Forschungszentrum Jülich / HHU Düsseldorf / Gunnar Schröder
Undersøgelser af fibrilprøven ved solid-state nuklear magnetisk resonansspektroskopi gav yderligere data til at bygge modellen og hjalp med at validere strukturen. "NMR gjorde det muligt for os at få yderligere oplysninger, f.eks. Hvilke aminosyrerester, der danner saltbroer, hvilket forbedrer fibrillernes stabilitet, " forklarer prof. Henrike Heise. Røntgendiffraktionseksperimenter overvåget af prof. Jörg Labahn ved Center for Structural Systems Biology i Hamborg bekræftede desuden resultaterne.
Kryo-elektronmikroskopi er en relativt ny forskningsmetode til bestemmelse af proteinmolekylers struktur. I fortiden, forskere brugte hovedsageligt røntgenkrystallografi og nuklear magnetisk resonansspektroskopi. I 2015 kryo-elektronmikroskopi blev kåret som årets forskningsmetode af tidsskriftet Naturens metoder . Med den veletablerede metode til røntgenkrystallografi, proteinerne skal først omdannes til en krystallinsk form, der henviser til, at med kryo-elektronmikroskopi og også NMR-spektroskopi, proteinets byggesten kan undersøges i deres naturlige tilstand. I tilfælde af kryo-elektronmikroskopi, prøverne opløses først i vand, blinker derefter frosset, og til sidst undersøgt med et elektronmikroskop. Denne metode har særlige fordele, når det kommer til at undersøge store strukturer sammensat af hundredvis eller tusinder af proteiner.
Etableringen af et anlæg til højopløsnings-kryo-elektronmikroskopi kunne give forskere ved Jülich mulighed for at undersøge biologiske molekyler. Ud over grundforskning, Jülich's Institute of Complex Systems (ICS-6) er også ved at udvikle en ny behandlingsstrategi med sin egen lægemiddelkandidat.
Sidste artikelForskere opfinder en ny proces til udvinding af sukker fra træ
Næste artikelNødmetode til måling af strontiumniveauer i mælk
 Varme artikler
Varme artikler
-
 Sådan forvandler du plastikaffald i din papirkurv til profitGemt fra skraldespanden og klar til forvandling. Kredit:Nathan Shaiyen/Michigan Tech, CC BY Folk vil genbruge, hvis de kan tjene penge på det. På steder, hvor der tilbydes kontanter til dåser og f
Sådan forvandler du plastikaffald i din papirkurv til profitGemt fra skraldespanden og klar til forvandling. Kredit:Nathan Shaiyen/Michigan Tech, CC BY Folk vil genbruge, hvis de kan tjene penge på det. På steder, hvor der tilbydes kontanter til dåser og f -
 Forskere isolerer kræftstamceller ved hjælp af en ny metodeForskere ved University of Texas i Dallas har udtænkt en ny teknik til at isolere kræftstamceller, som menes at danne roden til mange svære at behandle metastaserede kræftformer - et væsentligt skridt
Forskere isolerer kræftstamceller ved hjælp af en ny metodeForskere ved University of Texas i Dallas har udtænkt en ny teknik til at isolere kræftstamceller, som menes at danne roden til mange svære at behandle metastaserede kræftformer - et væsentligt skridt -
 Bæredygtig jernkatalyse muliggør kontrollerbar alkenboryleringFigur 1:Skematisk viser designet af fjernprotoborering for at opnå selektiv borylering ved mindre aktiverede β-positioner. Kredit:National University of Singapore Kemikere fra National University
Bæredygtig jernkatalyse muliggør kontrollerbar alkenboryleringFigur 1:Skematisk viser designet af fjernprotoborering for at opnå selektiv borylering ved mindre aktiverede β-positioner. Kredit:National University of Singapore Kemikere fra National University -
 Kemikere syntetiserer molekylære kringlerKredit:HIMS Kemikere ved University of Amsterdams Van t Hoff Institute for Molecular Sciences har opdaget en ny klasse af molekyler. I denne uge melder de ind Naturkommunikation på deres syntese
Kemikere syntetiserer molekylære kringlerKredit:HIMS Kemikere ved University of Amsterdams Van t Hoff Institute for Molecular Sciences har opdaget en ny klasse af molekyler. I denne uge melder de ind Naturkommunikation på deres syntese
- S, N co-doteret carbon nanorør-indkapslet CoS2@Co
- Miljøstøj bevarer paradoksalt nok sammenhængen i et kvantesystem
- Sådan konverteres MG til MEQ
- NASA ser atlantisk subtropisk storm Melissa dannes ud for New Englands kyst
- Kinas rumfartøj går ind i kredsløb om Mars, 2. på 2 dage efter UAE
- Fysikere opvarmer fritstående grafen for at kontrollere krumning af krusninger


