At opdage, hvad der får organeller til at forbinde, kan hjælpe med at forstå neurodegenerative sygdomme
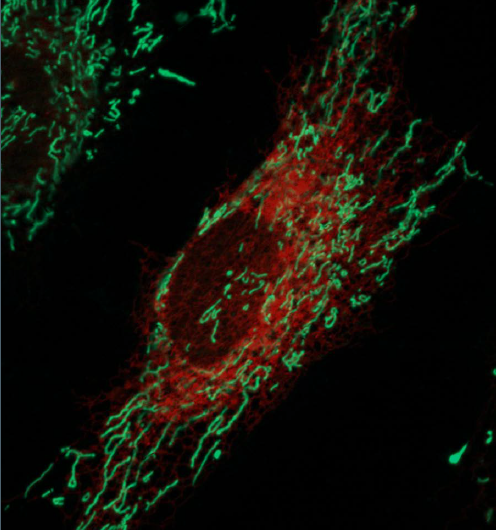
Live-afbildede HeLa-celler med det endoplasmatiske retikulum mærket rødt og mitokondrier mærket grønt. Kredit:Ginam Cho.
Inde i hver celle er en kompleks infrastruktur af organeller, der udfører forskellige funktioner. Organeller skal udveksle signaler og materialer for at få cellen til at fungere korrekt. Nye teknologier gør det muligt for forskere at se og forstå de netværk, der forbinder disse organeller, giver dem mulighed for at bygge kort over de handelsruter, der findes i en celle. En undersøgelse, der offentliggøres i 29. september -udgaven af Journal of Biological Chemistry rapporterer brugen af en ny metode til at identificere proteiner, der tillader to organeller, mitokondrier og det endoplasmatiske net, at knytte sig til hinanden.
"Tænk på [en organel] som en færge, der lægger til ved et sted, losning og lastning af passagerer og biler, og derefter gå til et andet websted og gøre det samme, "sagde Jeffrey Golden, en professor ved Brigham og Women's Hospital og Harvard Medical School, der havde tilsyn med arbejdet. "Deres evne til at lægge til, belastning, og aflæsning af last kræver guider eller ramper med specifik bredde og højder, der forbinder båden og land, eller de kan ikke frit laste og losse. "
Kontaktpunkter mellem det endoplasmatiske retikulum (ER) og mitokondrier er de "ramper" og "guider", der muliggør disse kontakter. De tillader vigtige aktiviteter som signalering, udveksling af calcium og lipider, og kontrol af mitokondriell fysiologi. Defekte forbindelser mellem ER og mitokondrier har været impliceret i flere neurodegenerative sygdomme, herunder Alzheimers, Parkinsons og Huntingtons sygdom. Proteinerne, der forbinder og bygger bro mellem ER og mitokondrier, er velstuderede i gær, men forbindelserne mellem disse organeller i flercellede organismer som pattedyr er mere komplekse og mindre forståede.
Golden's samarbejdspartner Ginam Cho og forsker Il-Taeg Cho havde ideen om at søge efter proteiner, der er vigtige for ER-mitokondriel kontakt ved hjælp af en metode, der for nylig blev udviklet til at vise kontakt mellem proteiner. Metoden drager fordel af et enzym kaldet ascorbatperoxidase, eller APEX, som kan vedhæfte biotin, almindeligvis kendt som vitamin B7, til proteiner i nærheden. Teamet konstruerede celler til at producere mitokondrier, der havde APEX fastgjort til deres ydre membraner, og derefter tilsat biotin til cellerne, som APEX kan bruges til at mærke proteiner i nærheden.
Holdet isolerede derefter dele af cellen, der indeholdt ER, rensede de proteiner, der havde bundet biotin, og identificerede dem, der findes i ER ved hjælp af massespektrometri. Fordi APEX var knyttet til mitokondrier, kun de proteiner, der kom i nærheden af mitokondrierne, kunne have haft biotin fastgjort. Dermed, biotinen fungerede som en slags passtempel, der angav, hvilke proteiner der havde været involveret i ER-mitokondrier-kontakten.
"Det var tidligere muligt kun at se på et molekyle ad gangen for at vurdere, hvad det interagerede med, "Golden sagde." Den metode, vi har brugt, er hurtigere og tillader et objektivt kig på et helt system og hvad der sker ved den organelles grænseflade. "
Ved hjælp af denne screeningsmetode, forskerne nulstillede et ER -protein kaldet RTN1a, som tidligere var kendt for at bidrage til ER's form. I opfølgningsforsøg, de bekræftede, at dette protein også hjalp mitokondrier med at knytte sig til ER.
Denne undersøgelse øger muligheden for, at defekter i RTN1a kan bidrage til de problemer, patienter med neurodegenerative sygdomme oplever, men forskerne ved det ikke sikkert, før de udfører yderligere eksperimenter, herunder lignende undersøgelser i neurale celler.
Golden spekulerer i, at de proteiner, der er vigtige for ER-mitokondriel kontakt, kan være forskellige i forskellige celletyper.
"Bruger leveren de samme proteiner til at kontrollere denne slags interaktioner, som neurale celler gør? Er et [protein] vigtigere for calciumudveksling og et andet sæt proteiner vigtigere for lipidudveksling?" Spurgte Golden. "Jeg tror, der er meget cellebiologi, som vi bare ikke kender og kunne besvares [ved hjælp af denne metode]."
Teamet bruger nu metoden APEX-massespektrometri til at sammenligne proteiner, der er involveret i ER-mitokondrielle kontakter mellem normale og patientafledte neurale celler.
"Der er mange interessante ting, vi kan gøre, "Sagde Il-Taeg Cho.
 Varme artikler
Varme artikler
-
 Nyt materiale kan hjælpe med at reducere batteriomkostningerne til elbiler, mobiltelefonerForskere ved University of Texas i Dallas og Seoul National University har designet et nyt batterikatodemateriale, der muligvis giver lavere omkostninger, mere miljøvenlig mulighed for lithium-ion-bat
Nyt materiale kan hjælpe med at reducere batteriomkostningerne til elbiler, mobiltelefonerForskere ved University of Texas i Dallas og Seoul National University har designet et nyt batterikatodemateriale, der muligvis giver lavere omkostninger, mere miljøvenlig mulighed for lithium-ion-bat -
 Opbygning af en bedre brændselscelle begynder med overfladekemiForskere kiggede dybt ind i en brændselscelles indre funktioner for at få et mere komplet billede af den katalytiske proces. Dette arbejde lover at forbedre design til mere effektive celler. Kredit:Na
Opbygning af en bedre brændselscelle begynder med overfladekemiForskere kiggede dybt ind i en brændselscelles indre funktioner for at få et mere komplet billede af den katalytiske proces. Dette arbejde lover at forbedre design til mere effektive celler. Kredit:Na -
 Galliumbaseret opløsningsmiddel analyserer effektivt optisk aktive alkoholerFigur:Skematisk afbildning af in-situ direkte 1H NMR chiral analyse. Kredit:Korea Advanced Institute of Science and Technology (KAIST) Et KAIST-forskerhold har udviklet et galliumbaseret metalkomp
Galliumbaseret opløsningsmiddel analyserer effektivt optisk aktive alkoholerFigur:Skematisk afbildning af in-situ direkte 1H NMR chiral analyse. Kredit:Korea Advanced Institute of Science and Technology (KAIST) Et KAIST-forskerhold har udviklet et galliumbaseret metalkomp -
 Ny proces gør kulstof til renere, højtydende diesel-biobrændstofblandingNREL-forskere holder op med det højtydende dieselbiobrændstof, der er udviklet ved hjælp af en ny katalytisk proces. Kredit:Dennis Schroeder, NREL En ny enfaset katalysator, der muliggør omdannels
Ny proces gør kulstof til renere, højtydende diesel-biobrændstofblandingNREL-forskere holder op med det højtydende dieselbiobrændstof, der er udviklet ved hjælp af en ny katalytisk proces. Kredit:Dennis Schroeder, NREL En ny enfaset katalysator, der muliggør omdannels
- Hvad er fremtiden for bioplast?
- Ny robot fremskynder prøvetagning af oceaners biogeokemi og sundhed
- Teamet identificerer tidligere uopdagede forskelle i korngrænser
- COVID-19 presser universiteter til at skifte til onlinekurser - men er de klar?
- Ny undersøgelse om tidlig menneskelig brandopsamling dæmper debatten
- Lidt rigt:Erhvervsgrupper ønsker akut klimaindsats efter at have modstået det i 30 år


