Forskere bruger lysfølsomme molekyler til at spore proteiner, der er kritiske for cellesignalering
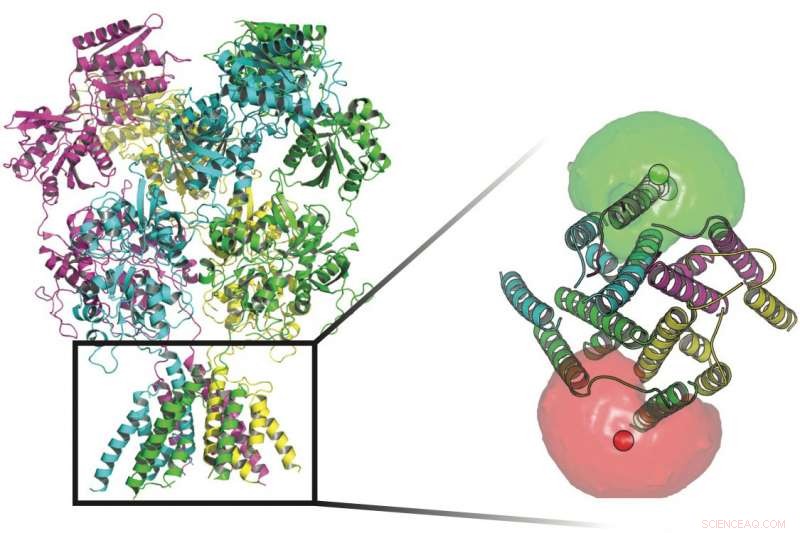
Forskere ved Rice University og UTHealth sporede konformationerne af proteiner, der står vagt ved transmembrane kanaler i nervecellernes vægge. I bunden af proteinerne på dette billede er fluoroforer (røde og grønne kugler) omgivet af fluoroforskyer, der hjalp forskerne med at definere bevægelserne af porten, der tillader ioner at strømme gennem membranen. Kredit:Rice University/UTHealth
Evnen til at spore enkelte molekylers bevægelser har afsløret, hvordan proteiner på overfladen af nerveceller styrer porte, der omdanner kemiske signaler til elektriske signaler. Fundet er et skridt fremad i at detaljere mekanismer involveret i neurologiske sygdomme, ifølge forskere ved Rice University og University of Texas Health Science Center i Houston (UTHealth).
Ved at bruge sofistikerede billeddannelses- og statistiske metoder, forskerne brugte enkelt-molekyle FRET-billeddannelsesteknikker til at etablere et strandhoved ved NMDA-receptorporten, der, når den er aktiveret, lader ioner strømme gennem nervecellens membran.
FRET står for Förster resonance energy transfer. Det er en måde at bruge lyset udsendt af to fluorescerende mærkede molekyler som en følsom lineal på meget små afstande, såsom åbningen i NMDA-receptorkanalen.
Riskemiker Christy Landes, en ekspert i enkelt-molekyle FRET, og Vasanthi Jayaraman, en professor i biokemi og molekylærbiologi ved UTHealth's McGovern Medical School, hvis ekspertise er i NMDA-receptorbiokemi, gik sammen om at samle de første eksperimentelle beviser, der beskriver dynamikken i, hvordan receptorerne ændrer deres former for at kontrollere portens følsomhed over for kemiske signaler. Den nye undersøgelse vises i Naturens kemiske biologi .
NMDA-receptoren består af fire proteinunderenheder, hver med fire domæner, og hvert af disse domæner har en særlig funktion. I fællesskab de spænder over cellemembranen. Hver underenhed kan have mange "tilstande, " eller former, der regulerer hvilke elektriske signaler - og hvor mange af dem - der passerer igennem. Underenhederne sidder på hver side af kanalen og aktiveres, når de binder både glutamat og glycin neurotransmitterligander og udløser signalvejen, der tillader positivt ladede ioner at passere ind i cellen.
"Disse receptorer er kritiske for normal fysiologisk funktion, " sagde Jayaraman. "Mange gange vil du måske ikke slå signalering til eller fra. Du ønsker måske at indstille omfanget af signalering. Når vi først forstår alle proteinets tilstande, vi kan begynde at tænke på måder at gøre dette på, dermed holde proteinet aktivt men i varierende grad efter behov.
"Det er vigtigt for udviklingen af lægemidler at forstå disse dynamikker, fordi bevægelserne og de energetiske egenskaber af disse proteiner dikterer deres specifikke funktioner, sagde hun. Vi var i stand til begge dele.
Denne viden kan føre til multifunktionelle lægemidler, der påvirker kanalerne på subtile måder, sagde Landes. Kendte NMDA-receptorantagonister inkluderer almindelige anæstetika, syntetiske opioider som metadon og dissociative stoffer som ketamin og dinitrogenoxid. Deprimeret NMDA-receptorfunktion er mistænkt i hukommelsessvigt, der almindeligvis er forbundet med aldring. Alkohol er kendt for at hæmme glutamat, en af to neurotransmittere, der binder til NMDA.

De fire underenheder af NMDA-receptorproteiner kan hver have mange tilstande, der regulerer, hvilke elektriske signaler der passerer gennem membranen i en nervecelle. Underenhederne aktiveres, når de binder både glutamat- og glycin-neurotransmitterligander og udløser signalvejen, der tillader positivt ladede ioner at passere ind i cellen. Kredit:Rice University/UTHealth
"Meget lægemiddeldesign har som kerneprincip, at der er én måde at binde på, og du dybest set enten tænder eller slukker noget, " sagde Landes. "Men det er indlysende, at denne type receptorprotein ikke bare er tændt eller slukket. Der er flere konformationelle interaktioner, der enten forbedrer eller forringer signaleringen."
I en tidligere undersøgelse, holdet analyserede konformationerne af et mindre og enklere, men relateret system, det C-klemmelignende agonistbindingsdomæne af en anden receptor, AMPA. AMPA medierer hurtig signaloverførsel i centralnervesystemet. Enkeltmolekyle FRET-teknikken gjorde det muligt for forskerne at få de første øjebliksbilleder af AMPA-proteinets forskellige klemmekonformationer i hvile og også når de var bundet til en række målmolekyler ved at måle afstanden mellem to lysaktiverede molekylære tags.
Denne gang, forskerne søgte at forstå selve kanalåbningen – hvordan proteinerne, der udgør NMDA-receptorkanalen, bevæger sig for at aktivere ionporten. Ved at tilføje fluorescerende tags på tværs af kanalen og prøve dem over tid, de var i stand til at kortlægge energilandskabet af proteinets transmembrane segment i dets hviletilstand eller under påvirkning af ligander, der modulerer porten blandt åbne, lukkede og mellemliggende tilstande. Hver kanals strukturelle tilstand påvirker direkte de elektriske signaler, der får lov til at passere.
De opdagede, at den agonistfrie (hvilende) tilstand er strukturelt stiv, hvilket bekræftede dens energiske modstand mod at adoptere konformationer, der ville tillade kanalåbning. Agonister som glutamat er målkemikalierne, der udløser elektrisk signaltransport gennem kanalen. Forskerne bekræftede, at i nærværelse af den primære agonist, NMDA-kanalen var mindre stiv og derfor i stand til at skifte lettere mellem de mulige kanalåbne konformationer.
Arbejdet viste også, hvordan to modulatorer, der er kendt for at interagere med forskellige dele af den fulde receptor, påvirkningskanal konformation og stivhed. Zink ioner, trods binding til den ekstracellulære del af receptoren langt væk fra kanalen, fremkalde en stiv kanal med betydelige energetiske barrierer for åbning, svarende til receptorens hviletilstand. I modsætning, "poreblokkeren" dizocilpin viste sig at øge energien i overgange mellem flere konformationer, der ikke relaterer til kanalåbning.
Landes sagde, at i stedet for at fange statiske tilstande, som man typisk gør med røntgenstråler, "Vi kiggede på afstandsændringer på tværs af kanalen på en dynamisk måde. Det er meget mere kompliceret." Det gav dem et datasæt mere beslægtet med en film end et øjebliksbillede, hun sagde.
Hun sagde, at undersøgelsen krævede nye teknikker til at rense og stabilisere de fulde proteiner, som blev trukket fra gnaveres neuroner. "Der var tre nøgleelementer til dette projekt:håndtering af de fulde proteiner, at få dem renset og mærket på enkelt-receptor niveau og udføre dataanalysen for at finde ud af, hvad det betyder.
"Det er virkelig grundlaget her, " sagde hun. "Nu kan vi lave disse målinger for meget mere komplicerede systemer."
 Varme artikler
Varme artikler
-
 Mikrobølger mod koldstart-emissionerDen geometriske keramiske struktur af testkatalysatoren designet på computeren. Specialister hos Empa coated det med det katalytisk aktive lag og testede renseeffekten i en kunstig strøm af udstødning
Mikrobølger mod koldstart-emissionerDen geometriske keramiske struktur af testkatalysatoren designet på computeren. Specialister hos Empa coated det med det katalytisk aktive lag og testede renseeffekten i en kunstig strøm af udstødning -
 Brug af neutroner til at studere, hvordan resistente bakterier udvikler sigBakterier, der indeholder enzymer kaldet beta-lactamaser, illustreret af den lyseblå klynge, nedbryde antibiotika og tillader bakterielle infektioner at udvikle sig og spredes gennem menneskelige cell
Brug af neutroner til at studere, hvordan resistente bakterier udvikler sigBakterier, der indeholder enzymer kaldet beta-lactamaser, illustreret af den lyseblå klynge, nedbryde antibiotika og tillader bakterielle infektioner at udvikle sig og spredes gennem menneskelige cell -
 Hvilke planter kan lære os om rensning af olieudslip og mikrofluidikÅrevis, forskere er blevet inspireret af naturen til at innovere løsninger på vanskelige problemer, selv olieudslip - menneskeskabte katastrofer med ødelæggende miljømæssige og økonomiske konsekvenser
Hvilke planter kan lære os om rensning af olieudslip og mikrofluidikÅrevis, forskere er blevet inspireret af naturen til at innovere løsninger på vanskelige problemer, selv olieudslip - menneskeskabte katastrofer med ødelæggende miljømæssige og økonomiske konsekvenser -
 Hvordan deformeres blodlegemer, komme sig, når man rejser gennem små kanalerRøde blodlegemer genopretter deres form på to måder efter at have strømmet gennem trange kanaler. Kredit:A. Amirouche, Université Lyon Laboratorieblodprøver udføres ofte ved at tvinge prøver genne
Hvordan deformeres blodlegemer, komme sig, når man rejser gennem små kanalerRøde blodlegemer genopretter deres form på to måder efter at have strømmet gennem trange kanaler. Kredit:A. Amirouche, Université Lyon Laboratorieblodprøver udføres ofte ved at tvinge prøver genne
- Reduktion af de høje sociale omkostninger ved døden
- Milepæl:Kapsel med dummy ombord på dokker ved rumstation (Opdatering)
- Slam:Hvordan virksomheder tvinger os til at bruge mere
- Kosmisk detektivarbejde:Hvorfor vi bekymrer os om rumsten
- Du opretter dine egne falske oplysninger, undersøgelse finder
- Eksempel på en parallelkreds


