Hvordan molekylære riboswitches virker i bakterier
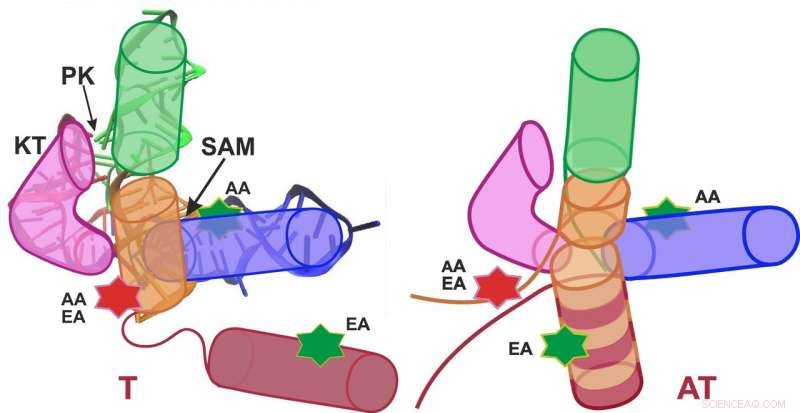
Skematisk repræsentation af SAM-I riboswitchen i terminatorkonformationen (sluk; venstre) og antiterminatorkonformationen (switch til; højre). Kredit:Grafik:APH/KIT
Mange bakterier har molekylære kontrolelementer, via hvilke de kan tænde og slukke for gener. Disse riboswitches åbner også for nye muligheder i udviklingen af antibiotika eller påvisning og nedbrydning af miljøgifte. Forskere fra Karlsruhe Institute of Technology (KIT), Heidelberg Universitet, og Freie Universität Berlin har nu brugt lysoptisk mikroskopi af enkelte molekyler til grundlæggende at studere den måde, riboswitches fungerer på. Dette er rapporteret i Naturens kemiske biologi .
Riboswitches er placeret på messenger-ribonukleinsyren (mRNA), der transporterer genetisk information til stedet for proteinbiosyntese. En riboswitch består af en sensor, der måler koncentrationen af et lille metabolisk molekyle og en effektor, der kontrollerer genekspression og, derfor, syntese af et protein. Da riboswitches findes i mange bakterielle patogener, de repræsenterer vigtige mål i udviklingen af nye antibiotika. Andre anvendelser er mulige inden for syntetisk biologi. For eksempel, bakterier kan genetisk modificeres med riboswitches for at detektere og nedbryde lavmolekylære miljøgifte, såsom herbicider. Imidlertid, grundlæggende forståelse af de processer, der ligger til grund for riboswitches funktion, er påkrævet. Værket præsenteret i Naturens kemiske biologi er et væsentligt bidrag i denne henseende.
Forskergrupperne af professor Gerd Ulrich Nienhaus fra KIT og professor Andres Jäschke fra Heidelberg Universitet studerede S-adenosyl-L-methionin (SAM)-I riboswitch. "Vedhæftning af SAM-molekylet til denne riboswitch forårsager konformationen, det er det rumlige arrangement af atomer, at skifte fra anti-terminator (AT) til terminator (T) struktur, " Nienhaus forklarer. "Som et resultat, genekspression er slået fra."
Først, videnskabsmændene i Heidelberg syntetiserede SAM-I riboswitches og mærkede dem specifikt med to fluorescerende farvestoffer hver på forskellige punkter. Forskerne fra KIT undersøgte derefter disse RNA-molekyler ved høj rumlig og tidsmæssig opløsning ved hjælp af meget følsomme lysmikroskoper, der målte fluorescerende emission af enkeltfarvede molekyler. Ved hjælp af Förster resonance energy transfer (FRET) eksperimenter, konformationsdynamikken blev bestemt direkte. Til dette formål, laserstråling bruges til at få et grønt farvestof til at udsende lys. Hvis et rødt farvestof er placeret i nærheden, det kan overtage excitationsenergien fra det grønne farvestof og udsende lys selv.
Sandsynligheden for energioverførsel afhænger stærkt af farvestoffernes afstand fra hinanden. Strukturelle ændringer af et molekyle, som farvestofferne er specifikt knyttet til, kan observeres direkte via emission af det røde farvestof. Lysemission er ekstremt svag, kræver komplekse dataanalysemetoder baseret på skjult Markov-modellering. Professor Bettina Keller fra Institut for Kemi og Biokemi ved Freie Universität Berlin udviklede metoderne specielt til denne type forsøg for at skelne tidsafhængige lysemissionssignaler fra støj.
I deres analyse, forskerne skelnede mellem to konformationer (T og AT) af SAM-I riboswitchen, og i alt fire konformationer (T1, T2, AT1, og AT2). Overraskende nok, riboswitchen skiftede ikke fuldt ud mellem T- og AT-strukturerne i nærvær og fravær af SAM, som forventet, men svingede permanent mellem alle stater - kun vægtning blev flyttet. Et resultat vigtigt for den biologiske funktion var, at strukturudsving observeret med en vedhæftet SAM var langt hurtigere end uden SAM. Da riboswitch-sekvensen på messenger-RNA'et er placeret direkte foran genet, der skal kontrolleres, RNA-molekylet skal danne en T-struktur (slukke) så hurtigt som muligt efter syntese i nærvær af SAM for at forhindre efterfølgende transskription af genet, der skal kontrolleres. Acceleration af strukturudsving ved SAM-fastgørelse sikrer således tilstrækkelig hurtig dannelse af en T-struktur. "Følgelig, dynamikken i SAM-I riboswitchen spiller en vigtig rolle for dens funktion, " siger Nienhaus. "Disse detaljerede indsigter i funktionen af et biomolekyle er resultaterne af en tværfaglig tilgang til fysik, bioteknologi, og teoretisk kemi."
 Varme artikler
Varme artikler
-
 Blyfri magnetiske perovskitterKredit:CC0 Public Domain Forskere ved Linköpings Universitet, Sverige, arbejder med perovskite-materialefamilien, har udviklet en optoelektronisk magnetisk dobbeltperovskit. Opdagelsen åbner mulig
Blyfri magnetiske perovskitterKredit:CC0 Public Domain Forskere ved Linköpings Universitet, Sverige, arbejder med perovskite-materialefamilien, har udviklet en optoelektronisk magnetisk dobbeltperovskit. Opdagelsen åbner mulig -
 Forskere bekræfter forskellige regioner i populært kulstoffangst og syntese opløsningsmiddelBagsiden af Physical Chemistry Chemical Physics viser et stiliseret billede af de forskellige regioner i SWIL, og hvordan kuldioxiden bevæger sig mellem regionerne baseret på temperatur. Kredit:Mike
Forskere bekræfter forskellige regioner i populært kulstoffangst og syntese opløsningsmiddelBagsiden af Physical Chemistry Chemical Physics viser et stiliseret billede af de forskellige regioner i SWIL, og hvordan kuldioxiden bevæger sig mellem regionerne baseret på temperatur. Kredit:Mike -
 Realtidsanalyse af MOF-adsorptionsadfærdSkematisk illustration af molekyler adsorberet på metalorganiske rammer med forskellige porer af forskellige strukturer, hvor In-situ røntgenkrystallografi er blevet udviklet til at klassificere hver
Realtidsanalyse af MOF-adsorptionsadfærdSkematisk illustration af molekyler adsorberet på metalorganiske rammer med forskellige porer af forskellige strukturer, hvor In-situ røntgenkrystallografi er blevet udviklet til at klassificere hver -
 Grøn brint:Hvorfor forbedres visse katalysatorer i drift?Mineralet erytrit består af kobolt- og arsenoxider med en molekylformel på (Co3(AsO4)2∙8H2O). Det er et modelsystem for en gruppe katalysatormaterialer, som forbedres med tiden. Kredit:CC BY 3.0, via
Grøn brint:Hvorfor forbedres visse katalysatorer i drift?Mineralet erytrit består af kobolt- og arsenoxider med en molekylformel på (Co3(AsO4)2∙8H2O). Det er et modelsystem for en gruppe katalysatormaterialer, som forbedres med tiden. Kredit:CC BY 3.0, via
- Onlinestuderende engagerer sig mere i forelæsninger end fysiske deltagere
- Astronomi og landskab i byen Caral, den ældste by i Amerika
- Wolves, der lever i tempererede Grasslands
- Hvad var skyld i det varmeste forår i det østlige Kina i 2018?
- Forskere fastslår genetisk mutation i kroniske natugler
- Ældste kendte akvatiske krybdyr tilbragte sandsynligvis tid på land


