Biologers nye peptid kan bekæmpe mange kræftformer
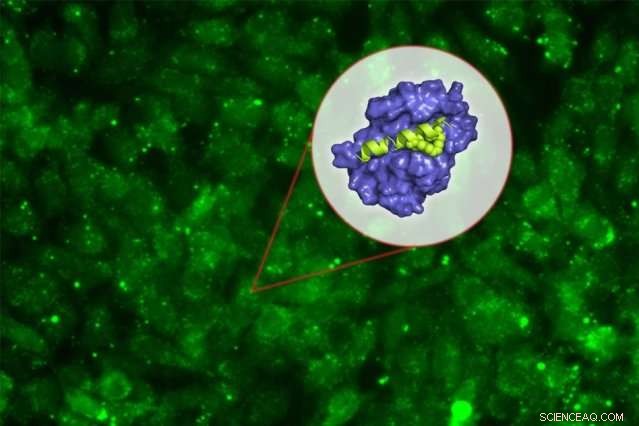
MIT-biologer har designet et nyt peptid, der kan forstyrre et nøgleprotein, som mange typer kræftformer, herunder nogle former for lymfom, leukæmi, og brystkræft, brug for at overleve. Kredit:Chelsea Turner/MIT
MIT-biologer har designet et nyt peptid, der kan forstyrre et nøgleprotein, som mange typer kræftformer, herunder nogle former for lymfom, leukæmi, og brystkræft, brug for at overleve.
Det nye peptid er rettet mod et protein kaldet Mcl-1, som hjælper kræftceller med at undgå det cellulære selvmord, der normalt induceres af DNA-skade. Ved at blokere Mcl-1, peptidet kan tvinge kræftceller til at gennemgå programmeret celledød.
"Nogle kræftceller er meget afhængige af Mcl-1, som er den sidste forsvarslinje, der forhindrer cellen i at dø. Det er et meget attraktivt mål, " siger Amy Keating, en MIT-professor i biologi og en af studiets seniorforfattere.
Peptider, eller små proteinfragmenter, er ofte for ustabile til at bruge som stoffer, men i denne undersøgelse, forskerne udviklede også en måde at stabilisere molekylerne og hjælpe dem med at komme ind i målcellerne.
Loren Walensky, en professor i pædiatri ved Harvard Medical School og en læge ved Dana-Farber Cancer Institute, er også seniorforfatter af undersøgelsen, som fremgår af Proceedings of the National Academy of Sciences ugen den 15. januar. Forskere i Anthony Letai's laboratorium, en lektor i medicin ved Harvard Medical School og Dana-Farber, var også involveret i undersøgelsen, og papirets hovedforfatter er MIT postdoc Raheleh Rezaei Araghi.
Et lovende mål
Mcl-1 tilhører en familie på fem proteiner, der spiller roller i at kontrollere programmeret celledød, eller apoptose. Hvert af disse proteiner har vist sig at være overaktive i forskellige typer kræft. Disse proteiner danner det, der kaldes en "apoptotisk blokade, "hvilket betyder, at celler ikke kan gennemgå apoptose, selv når de oplever DNA-skader, der normalt ville udløse celledød. Dette gør det muligt for kræftceller at overleve og proliferere ukontrolleret, og ser ud til at være en vigtig måde, hvorpå celler bliver resistente over for kemoterapimedicin, der beskadiger DNA.
"Kræftceller har mange strategier til at holde sig i live, og Mcl-1 er en vigtig faktor for mange akutte myeloid leukæmier og lymfomer og nogle fastvævskræftformer som brystkræft. Ekspression af Mcl-1 er opreguleret i mange kræftformer, og det blev set at være opreguleret som en resistensfaktor over for kemoterapier, " siger Keating.
Mange farmaceutiske virksomheder har forsøgt at udvikle lægemidler, der er målrettet mod Mcl-1, men dette har været vanskeligt, fordi interaktionen mellem Mcl-1 og dets målprotein sker i en lang strækning på 20 til 25 aminosyrer, som er svær at blokere med de små molekyler, der typisk bruges som lægemidler.
Peptidmedicin, på den anden side, kan designes til at binde tæt med Mcl-1, forhindrer den i at interagere med sin naturlige bindingspartner i cellen. Keatings laboratorium brugte mange år på at designe peptider, der ville binde til den del af Mcl-1, der var involveret i denne interaktion - men ikke til andre medlemmer af proteinfamilien.
Da de fandt frem til nogle lovende kandidater, de stødte på en anden forhindring, hvilket er vanskeligheden ved at få peptider ind i cellerne.
"Vi udforskede måder at udvikle peptider, der binder selektivt, og det havde vi stor succes med, men så konfronterede vi det problem, at vores korte, 23-rester peptider er ikke lovende terapeutiske kandidater, primært fordi de ikke kan komme ind i celler, " siger Keating.
For at prøve at overvinde dette, hun slog sig sammen med Walenskys laboratorium, som tidligere havde vist, at "hæftning" af disse små peptider kan gøre dem mere stabile og hjælpe dem med at komme ind i cellerne. Disse hæfteklammer, som består af kulbrinter, der danner tværbindinger i peptiderne, kan inducere normalt floppy proteiner til at antage en mere stabil spiralstruktur.
Keating og kolleger skabte omkring 40 varianter af deres Mcl-1-blokerende peptider, med hæfteklammer i forskellige positioner. Ved at teste alle disse, de identificerede et sted i peptidet, hvor anbringelse af en hæfteklammer ikke kun forbedrer molekylets stabilitet og hjælper det med at komme ind i cellerne, men får den også til at binde endnu tættere til Mcl-1.
"Det oprindelige mål med stiften var at få peptidet ind i cellen, men det viser sig, at hæfteklammer også kan forbedre bindingen og forbedre specificiteten, " siger Keating. "Det havde vi ikke forventet."
Dræber kræftceller
Forskerne testede deres top to Mcl-1-hæmmere i kræftceller, der er afhængige af Mcl-1 for at overleve. De fandt ud af, at inhibitorerne var i stand til at dræbe disse kræftceller på egen hånd, uden yderligere stoffer. De fandt også, at Mcl-1-hæmmere var meget selektive og ikke dræbte celler, der er afhængige af andre medlemmer af proteinfamilien.
Keating siger, at der er behov for flere tests for at bestemme, hvor effektive lægemidlerne kan være til at bekæmpe specifikke kræftformer, om lægemidlerne ville være mest effektive i kombination med andre eller alene, og om de skal bruges som førstevalgsmedicin, eller når kræftformer bliver resistente over for andre lægemidler.
"Vores mål har været at lave nok proof-of-principe til, at folk vil acceptere, at hæftede peptider kan trænge ind i celler og handle på vigtige mål. Spørgsmålet er nu, om der kan være foretaget nogen dyreforsøg med vores peptid, som ville give yderligere validering , " hun siger.
Joshua Kritzer, en lektor i kemi ved Tufts University, siger, at undersøgelsen giver bevis for, at den hæftede peptidtilgang er værd at forfølge og kan føre til nye lægemidler, der forstyrrer specifikke proteininteraktioner.
"Der har været en masse biologer og biokemikere, der studerede essentielle interaktioner mellem proteiner, med den begrundelse, at med mere forståelse for dem, vi ville være i stand til at udvikle lægemidler, der hæmmer dem. Dette arbejde viser nu en direkte linje fra biokemisk og biofysisk forståelse af proteininteraktioner til en inhibitor, " siger Kritzer, som ikke var involveret i undersøgelsen.
Keatings laboratorium designer også peptider, der kan interferere med andre slægtninge til Mcl-1, inklusive en kaldet Bfl-1, som er blevet mindre undersøgt end de andre medlemmer af familien, men som også er involveret i at blokere apoptose.
Denne historie er genudgivet med tilladelse fra MIT News (web.mit.edu/newsoffice/), et populært websted, der dækker nyheder om MIT-forskning, innovation og undervisning.
 Varme artikler
Varme artikler
-
 At løse fossilt mysterium kan hjælpe Mars med at søge efter livMikroskopiske strukturer skabt i laboratoriet. Kredit:Sean McMahon Forskning, der tyder på, at strukturer, der tidligere blev anset for at være fossiler, kan, faktisk, være mineralforekomster kunn
At løse fossilt mysterium kan hjælpe Mars med at søge efter livMikroskopiske strukturer skabt i laboratoriet. Kredit:Sean McMahon Forskning, der tyder på, at strukturer, der tidligere blev anset for at være fossiler, kan, faktisk, være mineralforekomster kunn -
 Biologisk nedbrydelig plast fra palmeolieaffaldKredit:CC0 Public Domain En bionedbrydelig film lavet af affald fra palmeolieindustrien kunne bruges til fødevareemballage Plastforurening er et presserende miljøproblem i det enogtyvende århundr
Biologisk nedbrydelig plast fra palmeolieaffaldKredit:CC0 Public Domain En bionedbrydelig film lavet af affald fra palmeolieindustrien kunne bruges til fødevareemballage Plastforurening er et presserende miljøproblem i det enogtyvende århundr -
 Rumtemperaturkonvertering af CO2 til CO:En ny måde at syntetisere kulbrinter påIllustration af en ny stuetemperaturproces til fjernelse af kuldioxid (CO 2 ) ved at omdanne molekylet til kulilte (CO). I stedet for at bruge varme, nanoskalametoden er afhængig af energien fra ove
Rumtemperaturkonvertering af CO2 til CO:En ny måde at syntetisere kulbrinter påIllustration af en ny stuetemperaturproces til fjernelse af kuldioxid (CO 2 ) ved at omdanne molekylet til kulilte (CO). I stedet for at bruge varme, nanoskalametoden er afhængig af energien fra ove -
 Grønnere biomaterialer og stilladser, der bruges i regenerativ medicinKredit:Pixabay/CC0 Public Domain Grøn fremstilling bliver en stadig mere kritisk proces på tværs af industrier, drevet af en stigende bevidsthed om de negative miljø- og sundhedsmæssige konsekvens
Grønnere biomaterialer og stilladser, der bruges i regenerativ medicinKredit:Pixabay/CC0 Public Domain Grøn fremstilling bliver en stadig mere kritisk proces på tværs af industrier, drevet af en stigende bevidsthed om de negative miljø- og sundhedsmæssige konsekvens
- Carbon fodbold med ekstra proton formentlig mest udbredt i rummet
- AI forstærker veggieburgere, efterhånden som markedet boomer
- Innovativ strategi til at lette organreparation
- Olierensning i det sydlige Nigeria er stadig langt fra målet
- Forskere måler nye dybder i bunden af den hydrologiske cyklus
- Forskere udvikler en indstillelig bio-billeddannelsesenhed ved hjælp af terahertz plasmonik


