Protein designet helt fra bunden fungerer i celler som et ægte enzym
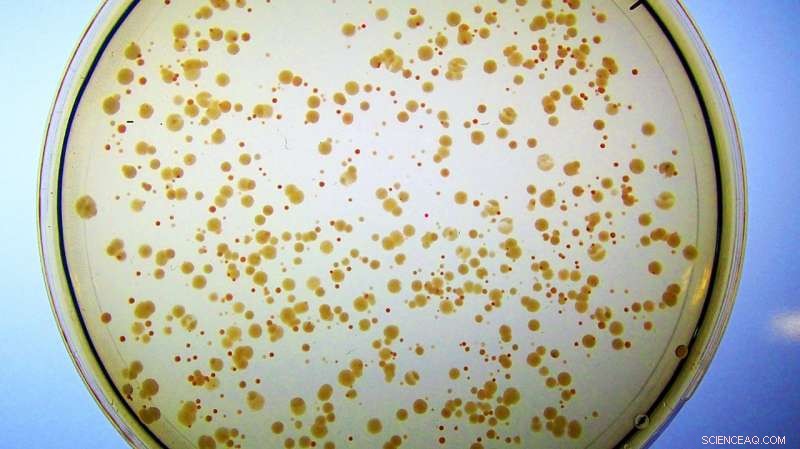
Kolonier af E. coli vokser på jernrigt medium. Alle celler blev konstrueret til at miste deres naturlige Fes-enzym. De danner små, usunde røde kolonier, fordi de ophober jern bundet til enterobactin, og har knap nok frit jern til at vokse. I modsætning, celler, der indeholder det kunstige enzym Syn-F4, danner store, sunde hvide kolonier, fordi det nye protein katalyserer spaltningen af enterobactin og efterfølgende frigivelse af det jern, der er nødvendigt for en sund vækst. (Bemærk:Hvis disse celler blev placeret på petriskåle med minimalt jern, de røde kolonier ville slet ikke dukke op, fordi de ikke ville have nok frit jern til at opretholde cellevækst.) Kredit:Ann Donnelly/Hecht Lab/Princeton University
Et gryende forskningsfelt, kunstig biologi, arbejder på at skabe en virkelig ny organisme. I Princeton, kemiprofessor Michael Hecht og forskerne i hans laboratorium designer og bygger proteiner, der kan folde og efterligne de kemiske processer, der opretholder liv. Deres kunstige proteiner, kodet af syntetiske gener, er cirka 100 aminosyrer lange, ved hjælp af et uendeligt varierende arrangement af 20 aminosyrer.
Nu, Hecht og hans kolleger har bekræftet, at mindst et af deres nye proteiner kan katalysere biologiske reaktioner, hvilket betyder, at et protein, der er designet helt fra bunden, fungerer i celler som et ægte enzym.
Enzymer er nøglen til al biologi, sagde Hecht. "Biologi er systemet af biokemiske reaktioner og katalysatorer. Hvert trin har et enzym, der katalyserer det, fordi ellers ville de reaktioner ikke gå hurtigt nok til, at livet kunne eksistere. ... Et enzym er et protein, der er en katalysator. De er de bedste katalysatorer i universet, fordi evolutionen har brugt milliarder af år på at udvælge dem. Enzymer kan øge hastigheden af en reaktion med mange størrelsesordener."
Da Hecht og hans forskerhold med succes havde skabt kunstige proteiner til E. coli, de begyndte at lede efter kritiske funktioner, som de kunne forstyrre i disse simple bakterier. De fandt fire gener, når den fjernes, ville ikke kun gøre E. coli inert - faktisk død - men som deres kunstige proteiner så kunne "redde, " eller genoplive.
De identificerede først disse kunstige proteiner i 2011, og de har brugt de sidste seks år på at finde ud af de præcise mekanismer, hvorved deres nye proteiner fungerede, nu detaljeret i en 15. januar papir i Naturens kemiske biologi .
Det er vigtigt ikke at antage, at et kunstigt protein vil fungere på samme måde som det naturlige protein, hvis sletning det redder, Hecht advarede.
Det tog utallige eksperimenter at bestemme de mekanismer, som deres kunstige proteiner brugte. "Vi havde fire forskellige gendeletioner - fire forskellige enzymatiske funktioner, " sagde Ann Donnelly, hovedforfatter på papiret.
Efter mange års eksperimenter, holdet havde konkluderet, at to af disse "redninger" fungerer ved at erstatte enzymer - proteiner, der tjener til at katalysere andre reaktioner, hjælpe dem med at fungere hurtigt nok til at opretholde liv - med proteiner, der ikke selv var enzymer, men som øger produktionen af andre processer i cellen, hun sagde. Den tredje viste fremskridt, men den fjerde havde frustreret flere forskere, der kom gennem Hechts laboratorium.
Men så Donnelly, som var kandidatstuderende, da hun forskede og nu er forskningsspecialist i bioinformatik ved University of Pittsburgh, knækkede koden.
"Dette kunstige protein, Syn-F4, var faktisk et enzym, " sagde Donnelly. "Det var et utroligt og utroligt øjeblik for mig - utroligt til det punkt, at jeg ikke ønskede at sige noget, før jeg havde gentaget det flere gange."
Hun fortalte kun Katie Digianantonio, en medstuderende, og Grant Murphy, en postdoc forsker, som er medforfattere til det nye papir. "Jeg sagde, "Jeg tror, det her er et enzym." Jeg viste dem de første data og sagde, "Sig ikke noget til Michael. Lad mig gøre det igen." Donnelly rensede proteinet igen, og skabte en ny, helt rent substrat for E. coli. "Jeg kørte alt igen fra forskellige forberedelser - og da resultatet holdt op, Jeg fortalte Michael, " hun sagde.
Ud af det originale sæt af proteiner, der kunne redde gendeletioner, dette er det eneste, der har vist sig at være et enzym - i hvert fald indtil videre, hun sagde.
"Vi har et helt nyt protein, der er i stand til at opretholde liv ved faktisk at være et enzym - og det er bare vanvittigt, " sagde Hecht.
Dette har betydelige konsekvenser for industrien, sagde Justin Siegel, fakultetsdirektør for Innovation Institute for Food and Health og en adjunkt i kemi, biokemi og molekylær medicin ved UC Davis Genome Center, som ikke var involveret i undersøgelsen.
"Bioteknologi bruger almindeligvis enzymer til at udføre industrielle processer til fremstilling af materialer, mad, brændstof og medicin, " sagde Siegel. "Brugen af disse enzymer i industrielle omgivelser starter ofte med et enzym, som naturen har udviklet i milliarder af år til et ikke-relateret formål, og derefter justeres proteinet for at forfine dets funktion til den moderne anvendelse. Rapporten her viser, at vi ikke længere er begrænset til de proteiner, der produceres af naturen, og at vi kan udvikle proteiner - som normalt ville have taget milliarder af år at udvikle sig - i løbet af få måneder."
Hechts team havde skabt en stamme af E. coli, der manglede enzymet Fes, uden hvilken den ikke kan få adgang til det jern, der er nødvendigt for at opretholde livet. "Vi har alle brug for jern, " sagde Hecht. "Selvom der er rigeligt med jern på jorden, biologisk tilgængeligt jern er ikke." Celler har udviklet molekyler som enterobactin, forklarede han, som kan opfange jern fra enhver tilgængelig kilde, men de har da brug for et værktøj - som Fes - til at vride jernet ud af enterobactinets stramme greb.
Denne modificerede E. coli-stamme havde ingen måde at udvinde, eller hydrolysere, jernet fra dets enterobactin, indtil den blev "reddet" af Syn-F4. Forskerne havde leveret jern til E. coli, men det farvede kun cellerne røde, da selv om de kunne akkumulere det bundne metal, de kunne ikke frigøre det fra enterobactin eller få adgang til det til cellulær brug.
"Og så bemærkede Ann ... de er ikke røde længere, de er hvide, hvilket tyder på, at cellerne kan nedbryde dette og få jernet, hvilket tyder på, at vi faktisk har et enzym!" sagde Hecht.
"Millioner af års evolution resulterede i Fes, et perfekt enzym til at hydrolysere enterobactin, " sagde Wayne Patrick, en lektor i biokemi ved University of Otago i New Zealand, som ikke var involveret i undersøgelsen. "Det er nemt nok at studere strukturen, funktion og mekanisme af Fes, og at udlede noget om dens udvikling ved at sammenligne den med relaterede sekvenser. Men det er meget sværere (og mere interessant) at spørge, om Fes er løsningen på det biokemiske problem med at hydrolysere enterobactin - eller om det er en af mange løsninger. Donnelly et al. har vist, at et enzym, der aldrig blev født (undtagen kunstigt, i deres laboratorium) kunne alligevel have været en lige så god løsning (havde det fået muligheden).
"Denne tankegang har flere implikationer, " forklarede Patrick. "Den ene er for det liv, der mangler at blive opdaget på Jorden. Måske en dag, vi finder et naturligt enzym, der ligner Syn-F4, men som tager Fes' plads i en eller anden mikroorganisme. I hvert fald nu, vi ved at se. En anden implikation er for astrobiologi. Hvis der er mange lige sandsynlige løsninger på et biokemisk problem, det bliver mere sandsynligt, at der er fundet en løsning andre steder i universet."
Forskere er på nippet til en ægte syntetisk biologi, sagde Hecht.
"E. coli har 4, 000 forskellige gener, " sagde han. "Vi testede ikke alle 4, 000, fordi den eneste måde dette eksperiment fungerer på er, hvis intet vokser på minimalt medium, og af de 4, 000, det er kun sandt for nogle.
"Vi begynder at kode for et kunstigt genom. Vi har reddet 0,1 procent af E. coli-genomet ... For nu, det er en mærkelig E. coli med nogle kunstige gener, der tillader den at vokse. Antag, at du erstatter 10 procent eller 20 procent. Så er det ikke bare en mærkelig E. coli med nogle kunstige gener, så må du sige, at det er en ny organisme."
Sidste artikelDen kemiske udvikling af DNA og RNA på den tidlige Jord
Næste artikelDe tidlige stykker af livet
 Varme artikler
Varme artikler
-
 Forsker udvikler metode til at ændre fundamental arkitektur af polymererAdjunkt Justin Kennemur og kandidatstuderende Taylor Isais er medforfattere på en ny undersøgelse om, hvordan man ændrer den grundlæggende struktur af en polymer. Kredit:Bruce Palmer/FSU Et forskn
Forsker udvikler metode til at ændre fundamental arkitektur af polymererAdjunkt Justin Kennemur og kandidatstuderende Taylor Isais er medforfattere på en ny undersøgelse om, hvordan man ændrer den grundlæggende struktur af en polymer. Kredit:Bruce Palmer/FSU Et forskn -
 Varmbrygget kaffe har højere niveauer af antioxidanter end koldtbryggetUndersøgelsesforfattere Megan Fuller (højre) og Niny Rao (venstre), fakultet ved Jefferson (Philadelphia University + Thomas Jefferson University) Kredit:Jefferson (Philadelphia University + Thomas Je
Varmbrygget kaffe har højere niveauer af antioxidanter end koldtbryggetUndersøgelsesforfattere Megan Fuller (højre) og Niny Rao (venstre), fakultet ved Jefferson (Philadelphia University + Thomas Jefferson University) Kredit:Jefferson (Philadelphia University + Thomas Je -
 Maling med halvlederePerovskite portræt af Marie Skłodowska-Curie. Kredit:Lukas Helmbrecht AMOLF-forskerne Lukas Helmbrecht og Wim Noorduin har udviklet en reaktiv blæk, der kan males på et lige så reaktivt lærred. Bl
Maling med halvlederePerovskite portræt af Marie Skłodowska-Curie. Kredit:Lukas Helmbrecht AMOLF-forskerne Lukas Helmbrecht og Wim Noorduin har udviklet en reaktiv blæk, der kan males på et lige så reaktivt lærred. Bl -
 Supersimuleringer giver frisk indsigt i serotoninreceptorerKredit:A. James Clark School of Engineering, University of Maryland Forskere ved University of Maryland (UMD) og National Institute of Standards and Technology (NIST) har opdaget en måde at opdage
Supersimuleringer giver frisk indsigt i serotoninreceptorerKredit:A. James Clark School of Engineering, University of Maryland Forskere ved University of Maryland (UMD) og National Institute of Standards and Technology (NIST) har opdaget en måde at opdage
- Kuldioxidniveauer højest i 3 millioner år, viser en hidtil uset computersimulering
- IBM afslører en ny energibesparende optisk modtager med en ny rekord for hurtig tænd/sluk-tid
- Forklarer den accelererende udvidelse af universet uden mørk energi
- Ekstraordinært stærkt, ikke-lineært optisk grafenlignende materiale kunne renovere ikke-lineær f…
- Hvordan man bestemmer mol i kemi
- Miniature VVS sporer lægemiddeludvikling hurtigt


