Højtliggende fugle udvikler lignende egenskaber via forskellige mutationer
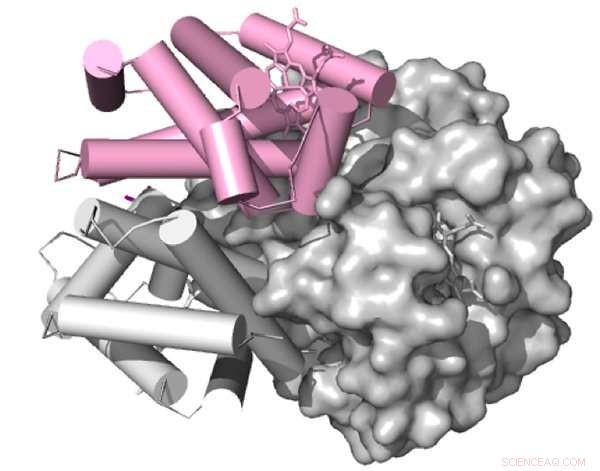
En gengivelse af aviær hæmoglobin, blodproteinet, der fanger og leverer ilt i hele kroppen. Kredit:Proceedings of the National Academy of Sciences USA
På det tibetanske plateau i Himalaya og Altiplano-plateauet i Sydamerika-verdens to højeste bordplader-overlever nogle få udvalgte fuglearter på 35 til 40 procent mindre ilt end ved havets overflade.
Alle fugle i ekstrem højde har udviklet særligt effektive systemer til at levere den dyrebare ilt til deres væv. Men en ny undersøgelse ledet af University of Nebraska-Lincoln og det kinesiske videnskabsakademi har fundet ud af, at disse fugle ofte udviklede forskellige tegninger til at samle de proteiner - hæmoglobiner - der faktisk fanger ilt.
Udgivet i Proceedings of the National Academy of Sciences , undersøgelsen viste, at mange arter fra de to plateauer undergik forskellige mutationer for at producere det samme resultat:hæmoglobiner, der er dygtigere til at fange ilt fra lungerne, før de deler det med de andre organer, der er afhængige af det.
Disse mutationsforskelle dukkede ofte op selv blandt nært beslægtede arter, der bor på samme plateau, rapporterede undersøgelsen.
"Du kunne forestille dig, bare på grund af de forskellige forfædres udgangspunkter, at de tibetanske fugle måske alle gik én (mutations)rute, og de andinske fugle gjorde tingene på en anden måde, " sagde medforfatter Jay Storz, Susan J. Rosowski professor i biologiske videnskaber i Nebraska. "Men det var ikke det, vi så. Overordnet set, der var ikke rigtig nogen regionsspecifikke mønstre.
"I begge tilfælde det ser ud til, at der var mange forskellige måder at udvikle en lignende ændring af proteinfunktionen på."

Jay Storz står på det tibetanske plateau, mere end 15, 000 fod over havets overflade. Storz og hans kolleger har vist, at mange højtliggende fuglearter gennemgik forskellige mutationer for at udvikle den samme tilpasning:hæmoglobin bedre til at fange og distribuere knap ilt. Kredit:University of Nebraska-Lincoln
Som alle proteiner, hæmoglobin består af indviklet foldede kæder af aminosyrer. Interaktionerne mellem disse aminosyrer dikterer strukturen af et protein, som igen bestemmer dets egenskaber – hvor let det binder sig med og frigiver ilt, for eksempel. Men en mutation kan effektivt bytte en aminosyre ud med en kemisk adskilt version på det samme sted i proteinet, potentielt ændre dens adfærd i processen.
Efter at have sammenlignet de forfædres vs. moderne hæmoglobinproteiner af ni arter, der bebor det tibetanske plateau, holdet identificerede to tilfælde, hvor fjernt beslægtede arter gennemgik identiske, funktionelt vigtige mutationer. Men i de andre tilfælde, arter udviklede forskellige måder at opbygge et bedre hæmoglobin på.
De seneste resultater forstærker en Storz-ledet undersøgelse fra 2016 offentliggjort i tidsskriftet Videnskab , som var den første til at fastslå, at hvirveldyrarter kan følge forskellige veje på molekylært niveau for at nå den samme tilpasning. Det studie, som kun undersøgte fugle fra Andesbjergene, inspirerede holdet til at følge op med deres sammenligning af Andes- og Himalaya-arter.
"Fugle, der har tilpasset sig højhøjdeforhold fra alle disse forskellige bjergkæder, har gentagne gange udviklet hæmoglobin med forhøjede iltaffiniteter, " sagde Storz. "På det (funktionelle) niveau, alt er meget gentageligt, og der er et meget slående mønster af konvergent evolution. Men med hensyn til det faktiske molekylære grundlag, der er langt mindre forudsigelighed, og det er klart, at der er mange mulige ændringer, der kan give det samme funktionelle resultat."
 Varme artikler
Varme artikler
-
 Oleo Sponge succesfuld under virkelige forhold ud for Californiens kystEt team af Argonne-forskere testede med succes Oleo-svampen ud for det sydlige Californiens kyst i april. Fra venstre mod højre:Argonnes Seth Darling, Jeff Elam og Ed Barry. Kredit:Argonne National La
Oleo Sponge succesfuld under virkelige forhold ud for Californiens kystEt team af Argonne-forskere testede med succes Oleo-svampen ud for det sydlige Californiens kyst i april. Fra venstre mod højre:Argonnes Seth Darling, Jeff Elam og Ed Barry. Kredit:Argonne National La -
 Fremtiden for elektroniske enheder:Stærke og selvhelbredende iongelerIongelen udviser hurtig selvhelbredende evne ved stuetemperatur ved at omdanne hydrogenbindinger på den beskadigede overflade. Brudspændingen af iongelen efter heling 3 timer er sammenlignelig med d
Fremtiden for elektroniske enheder:Stærke og selvhelbredende iongelerIongelen udviser hurtig selvhelbredende evne ved stuetemperatur ved at omdanne hydrogenbindinger på den beskadigede overflade. Brudspændingen af iongelen efter heling 3 timer er sammenlignelig med d -
 Katalysatorfremføring fjerner forurenende stoffer ved lave temperaturerYong Wang, Voiland Distinguished Professor, Gene og Linda Voiland School of Chemical Engineering and Bioengineering. Kredit:WSU Forskere ved Washington State University, University of New Mexico,
Katalysatorfremføring fjerner forurenende stoffer ved lave temperaturerYong Wang, Voiland Distinguished Professor, Gene og Linda Voiland School of Chemical Engineering and Bioengineering. Kredit:WSU Forskere ved Washington State University, University of New Mexico, -
 Verdens første passive anti-frosting overflade bekæmper is med isAfisning af fly ved hjælp af frostvæskekemikalier er en almindelig praksis i vintermånederne. Virginia Techs nye anti-frosting teknologi har potentiale til brug i rumfartsapplikationer, inklusive frem
Verdens første passive anti-frosting overflade bekæmper is med isAfisning af fly ved hjælp af frostvæskekemikalier er en almindelig praksis i vintermånederne. Virginia Techs nye anti-frosting teknologi har potentiale til brug i rumfartsapplikationer, inklusive frem
- Eventyr i akustisk kosmologi
- Plesiosaur fossil fundet for 33 år siden giver nye konvergerende evolutionsfund
- En forbedret ruthenium-baseret katalysator til primær aminsyntese
- Fire grundlæggende typer Motion
- Verden ser hurtig stigning i ekstremt vejr:rapport
- Flyrejser reducerer lokal investeringsbias, til gavn for investorer og virksomheder, viser undersøg…


