Et protein, der replikerer sig selv

Søer i vulkanske omgivelser kunne have været grobund for de første biokemiske forbindelser for omkring 4 til 4,5 milliarder år siden. Kredit:Dhilung Kirat/Wikimedia, ETH Zürich
ETH -forskere har været i stand til at bevise, at en proteinstruktur, der er udbredt i naturen - amyloidet - er teoretisk i stand til at formere sig selv. Dette gør den til en potentiel forgænger for molekyler, der betragtes som livets byggesten.
Længe betragtet som en biologisk aberration, amyloider er fibrøse aggregater af korte proteinfragmenter. Amyloider har et dårligt ry, fordi de menes at være årsagen til flere neurodegenerative sygdomme, herunder Alzheimers, Parkinsons og Creutzfeldt -Jakobs sygdom.
Det var først for nylig, at forskere opdagede, at amyloider fremstår som strukturelle og funktionelle byggesten i en lang række livsformer, fra bakterier, gær og svampe til mennesker. Hos hvirveldyr, de spiller en rolle i produktionen af pigmentet melanin, mens gærceller bruger amyloidaggregater til at danne en slags molekylær hukommelse.
Katalysatorer i præbiotisk udvikling
Består af korte peptider, amyloidfibre kan fremskynde kemiske reaktioner på lignende måde som enzymer; de er således blevet betragtet i flere år som kandidater til livets første forløbermolekyler. Indtil nu, imidlertid, en vigtig kemisk egenskab manglede i teorien om amyloids rolle i abiogenese:selvreplikation.
Tidlige fortalere for amyloidhypotesen omfatter ETH -professor Roland Riek og hans seniorassistent Jason Greenwald, fra Laboratory of Physical Chemistry. I et eksperiment, de har nu kunnet vise, at amyloider kan tjene som en kemisk skabelon til syntese af korte peptider. Og det kritiske punkt:"Denne evne gælder muligvis også selve amyloidet-hvilket betyder, at molekylerne kan replikere sig selv, "siger Riek. Forskerne rapporterede deres fund i en undersøgelse i Naturkommunikation .
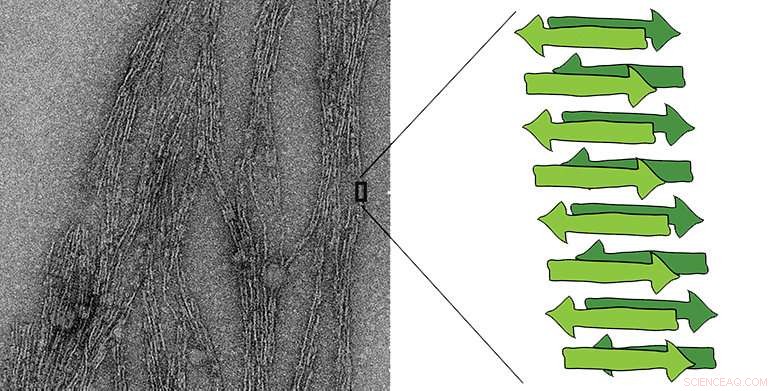
Til venstre:elektronmikrograf af en amyloidfiber. I grønt er et diagram over arkstrukturen karakteristisk for amyloider, bestående af flere korte peptidkæder. Kredit:Jason Greenwald/ETH Zürich
Skabelon til selvreplikation
Evnen til at replikere sig selv betragtes som en væsentlig forudsætning for enhver tidlig form for liv. Ved at bevise, at amyloider selvreplikerer, Riek og hans team har ikke kun fremhævet et andet fantastisk aspekt af dette almindeligt undervurderede protein, men også udfyldt et tidligere manglende led i amyloidhypotesens argument.
Næsten to år tidligere, ETH -forskerne havde allerede bevist i et forsøg, at amyloide strukturer spontant kan dannes med forbløffende let - fra simple aminosyrer, der sandsynligvis allerede eksisterede, da Jorden stadig var livløs, og under reaktionsbetingelser, der forekommer meget sandsynlige for ursuppen (som ETH News rapporterede).
Det samme gælder for den nyopdagede peptidsyntese:"Reaktionsmekanismen synes at være af generel karakter. Den er stabil over en lang række temperaturer og saltkoncentrationer, i både sure og alkaliske miljøer, "forklarer Greenwald.
Denne opdagelse styrker forskernes opfattelse af, at tidligt i evolutionær historie amyloider kunne have spillet en central rolle i udviklingen af tidlige livsformer som informationsbærere og katalytiske enheder.

Selvreplikationsmekanismen for amyloidfibre afbildet skematisk:stykke for stykke, specifikke aminosyrer (farvede byggesten) sætter sig på det rigtige sted og kombineres kemisk. Under processen, den voksende amyloid fungerer som en skabelon for sig selv. Kredit:Lukas Frey/ETH Zürich
Ikke bare en RNA -verden
Indtil nu, imidlertid, den mest udbredte idé til livets molekylære begyndelse har været RNA -hypotesen, som ser ribonukleinsyre (RNA) som den eneste nøglespiller i den præbiotiske ursuppe. Dette er fordi, ligesom det genetiske materiale DNA, RNA -molekyler kan kode oplysninger, og er også i stand til at replikere sig selv.
ETH-forskerne plukker nu væk fra det fremherskende dogme i en RNA-baseret verden. De synes, at amyloidhypotesen er mere plausibel; for det første, fordi RNA -molekyler med en biologisk funktion er meget større og mere komplekse, så det er usandsynligt, at de dannes spontant under præbiotiske forhold. "Derudover amyloider er meget mere stabile end tidlige nukleinsyrepolymerer, og de har en meget enklere abiotisk synteserute sammenlignet med kompleksiteten af kendte katalytiske RNA'er, "siger Greenwald.
Riek tilføjer:"Vi vil aldrig være i stand til at bevise, hvad der er sandt - at gøre det, vi skulle vende de sidste 4 til 4,5 milliarder års evolution tilbage. Imidlertid, vi formoder, at det ikke var en, men flere molekylære processer med forskellige forgængermolekyler, der var involveret i skabelsen af liv. "
 Varme artikler
Varme artikler
-
 Wafer-skala flerlags fremstilling af silke fibroin-baseret mikroelektronikFigur 1. Forsiden af ACS anvendte materialer og grænseflader . Kredit: ACS anvendte materialer og grænseflader Et KAIST-forskerhold udviklede en ny fremstillingsmetode til flerlagsbehandling af
Wafer-skala flerlags fremstilling af silke fibroin-baseret mikroelektronikFigur 1. Forsiden af ACS anvendte materialer og grænseflader . Kredit: ACS anvendte materialer og grænseflader Et KAIST-forskerhold udviklede en ny fremstillingsmetode til flerlagsbehandling af -
 Materialeforskere lærer at lave flydende krystal-formskiftForskere har også 3D-printet strukturer lavet af to lag LCE med forskellige egenskaber og viste, at dette gav materialet endnu flere grader af frihed til at aktivere. Forskere trykte også gitterstrukt
Materialeforskere lærer at lave flydende krystal-formskiftForskere har også 3D-printet strukturer lavet af to lag LCE med forskellige egenskaber og viste, at dette gav materialet endnu flere grader af frihed til at aktivere. Forskere trykte også gitterstrukt -
 Bakterielle biofilm, forsvindEn kunstners repræsentation af bakterier (lilla) bliver kompromitteret af en organisk rammefilm i kitosan-metal. Kredit:Colorado State University/ Avancerede funktionelle materialer Efter nogle
Bakterielle biofilm, forsvindEn kunstners repræsentation af bakterier (lilla) bliver kompromitteret af en organisk rammefilm i kitosan-metal. Kredit:Colorado State University/ Avancerede funktionelle materialer Efter nogle -
 Neutroner afslører den vilde Weyl-verden af halvmetallerWeyl-semimetalltilstanden induceres, når elektronernes modsatte bevægelser får Dirac-keglerne til at dele sig i to (illustreret til venstre af udadvendte elektroner, modsat de indadvendte elektroner t
Neutroner afslører den vilde Weyl-verden af halvmetallerWeyl-semimetalltilstanden induceres, når elektronernes modsatte bevægelser får Dirac-keglerne til at dele sig i to (illustreret til venstre af udadvendte elektroner, modsat de indadvendte elektroner t
- Størrelsen er nøglen til at forudsige, hvordan forkalkede organismer vil reagere på havforsuring
- Går dybt for at måle Jordens rotationseffekter
- Facebook annoncerer første originale nyhedsudsendelser, med partnere
- Brug af kunstig intelligens til at lugte roserne
- Brug af industriaffald som isolering til bygninger
- Bliv begejstret af neurale netværk


