Kemikere bruger teknologi til at afkode sproget for lipid-protein-interaktion
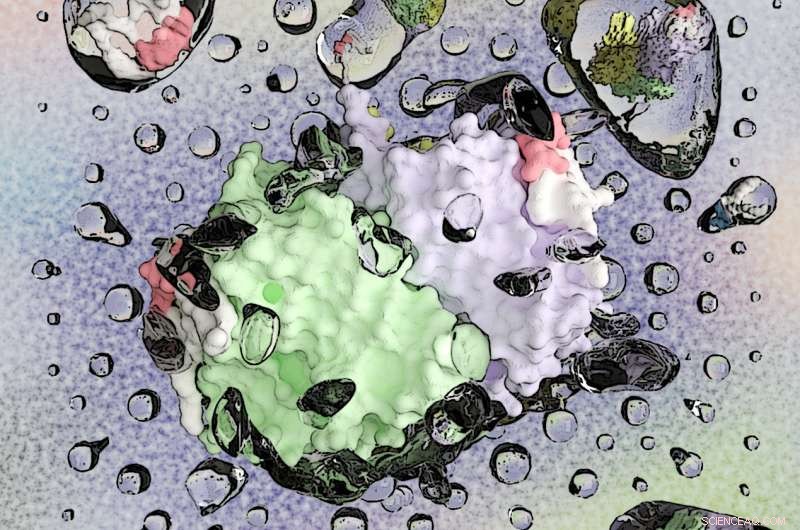
Membranproteinprøver infunderes i massespektrometrien ved hjælp af nanoflow elektrospray-ionisering (nESI). I dette kunstværk, frie og lipidbundne membranproteiner dukker op fra dråber i nESI-processen før de kommer ind i massespektrometeret. Kredit:Laganowsky Laboratory, Texas A&M University
Teknologi har en massiv indflydelse på vores daglige liv, helt ned på celleniveau i vores egen krop. Texas A&M University kemikere bruger det til at bestemme, hvordan lipider taler med hinanden, når de interagerer med membranproteiner, et af de primære mål for lægemiddelopdagelse og potentielle behandlinger for en række forskellige sygdomme.
Ved at udnytte deres teknologiske ekspertise til at "se" membranproteiner, når de interagerer med forskellige lipider, Texas A&M kemiker Dr. Arthur Laganowskys forskningsgruppe har opdaget overbevisende beviser på, at disse proteiner kan være i stand til at rekruttere deres egne lipidmikromiljøer gennem allosteri, et biologisk fænomen, der først blev observeret i 1900-tallet og identificeret i adskillige biologiske processer, herunder cellulær signalering, transkriptionel kontrol og sygdom.
Teamets arbejde, udgivet i dag (5. marts) i Proceedings of the National Academy of Sciences og ledet af Texas A&M kemi postdoc-forskere Christopher Boone og John W. Patrick, viser, at allosteri strækker sig til lipid-membranproteininteraktioner, gør det muligt for disse proteiner at ændre deres fjerntliggende bindingssteder for at acceptere lipider af forskellige typer og åbner op for nye muligheder for farmaceutisk lægemiddeldesign og levering.
Fra beskyttelse til kommunikation
Beskyttende membraner findes på overfladen af alle levende celler og indeholder mange af vores cellers vigtigste proteiner, hvoraf mange har unikke og specialiserede funktioner, såsom at sikre den last, der går ind og ud af cellen, som er nødvendig for cellens overlevelse. Disse membraner består stort set af lipider, som selv spiller nøgleroller i at opretholde membranintegritet og sikre, at disse specialiserede membranproteiner fungerer korrekt.
"Fra dette arbejde og vores tidligere arbejde, det bliver mere og mere klart, at membranproteiner er udsøgt følsomme over for lipidets kemi, " siger Laganowsky. "I betragtning af at lipidsammensætningen er forskellig fra hele kroppens organer, at forstå, hvordan lipidmiljøet i disse områder påvirker proteinstrukturen, vil være afgørende for at åbne nye muligheder for farmaceutiske lægemidler designet til at påvirke, hvordan disse lipider binder til hinanden."
Membranproteiner repræsenterer et af de vigtigste mål for opdagelse af farmaceutiske lægemidler, med svimlende 60 procent af lægemidlerne på det nuværende marked rettet mod dem for deres integrerede rolle i cellulære processer. Lipiders afgørende rolle i foldningen, struktur og funktion af membranproteiner dukker op gennem adskillige forskningsrapporter og kanaler - resultater, der afslører de intime roller lipid-protein-interaktioner spiller i kontrollen af proteinstruktur og funktion.
"I en celle, molekylære interaktioner med molekyler udnyttes til at udføre cellulære processer, Laganowsky forklarer. "F.eks. når du spiser en chilipeber, du føler en varm fornemmelse som et resultat af, at et molekyle i peberen binder sig til et specifikt membranprotein, som på tur, fremkalder dette svar. På lignende måde, vores undersøgelse har vist, at membranproteinet kan påvirke dets omgivende lipidmiljø, og dette miljø kan påvirke, for eksempel, hvordan molekyler fornemmes."
Barrierer for et gennembrud
Membranproteiner udfører essentielle cellulære funktioner, herunder signalering og transport af molekyler gennem blod-hjerne-dobbeltlaget, som de fleste stoffer har svært ved at krydse. Disse proteiner er indlejret i det kemisk komplekse lipidmiljø i den biologiske membran, som giver unikke udfordringer med at dechifrere de roller, som lipider spiller i modulering af membranproteinstruktur og funktion.
Til dato, teknologi, eller mangel på samme, har været den primære barriere for sådanne undersøgelser. Ud over deres ekspertise i at bruge røntgenkrystallografi til at bestemme atomstrukturen af proteiner, Laganowskys laboratorium var et af de første i USA til at perfektionere brugen af banebrydende native ion-mobilitets-massespektrometri - en teknik, han var med til at udvikle som postdoktor ved University of Oxford - som har gjort det muligt for hans gruppe at dechifrere sprogets lipider og membraner. proteiner bruges til at kommunikere. Ved at kaste nyt lys over, hvordan lipid-protein-interaktioner kan øge eller svække binding af andre lipidtyper, deres forskning ændrer vores forståelse af den strukturelle dynamik af proteiner på cellulære membranniveauer og giver ny indsigt med kraften til at transformere lægemiddeldesign, udvikling og levering.
"Der er et kritisk behov for at udvide vores grundlæggende viden på dette nye område ved at anvende og udvikle innovative tilgange til at belyse, hvordan lipider modulerer strukturfunktionen af membranproteiner, " siger Laganowsky. "Til dette formål, vi fortsætter med at studere en række ionkanaler, receptorer og andre typer membranproteiner."
Wen Liu, Yang Liu og Xiao Cong, tidligere medlemmer af Laganowskys laboratorium i Texas A&M Health Science Center's Institute of Biosciences and Technology (IBT), også samarbejdet i forskningen, ligesom Dr. Gloria Conover, en assisterende forsker i Laganowskys gruppe siden 2017.
 Varme artikler
Varme artikler
-
 Visualisering af stress i plastDet udviklede farvestof viser stress af forskellig størrelse i plastkomponenter. Hvorvidt dette virker, blev undersøgt ved hjælp af mekaniske eksperimenter på testprøver indeholdende farvestoffet. Kre
Visualisering af stress i plastDet udviklede farvestof viser stress af forskellig størrelse i plastkomponenter. Hvorvidt dette virker, blev undersøgt ved hjælp af mekaniske eksperimenter på testprøver indeholdende farvestoffet. Kre -
 Ny belægning bringer lithiummetalbatteri tættere på virkelighedenHovedforfattere og ph.d. studerende David Mackanic, venstre, og Zhiao Yu med deres batteritester til højre. Yu holder et fad med allerede testede celler, som de kalder batterikirkegården. Kredit:Mark
Ny belægning bringer lithiummetalbatteri tættere på virkelighedenHovedforfattere og ph.d. studerende David Mackanic, venstre, og Zhiao Yu med deres batteritester til højre. Yu holder et fad med allerede testede celler, som de kalder batterikirkegården. Kredit:Mark -
 Iagttager en skiftende platinelektrodeKredit:Leiden University Overfladen på platinelektroder ændrer sig meget mere under brug end tidligere antaget. I et samarbejde mellem Leiden Institutes of Chemistry and Physics, kemikere Leon Jac
Iagttager en skiftende platinelektrodeKredit:Leiden University Overfladen på platinelektroder ændrer sig meget mere under brug end tidligere antaget. I et samarbejde mellem Leiden Institutes of Chemistry and Physics, kemikere Leon Jac -
 Forskere visualiserer strukturen af et nøgleenzym, der fremstiller triglyceriderEt første kig på strukturen af lipin-enzymet. Strukturen viser, hvordan to væsentlige områder (farvet blå og pink), placeret på modsatte ender af proteinet hos mennesker, samles for at danne et funk
Forskere visualiserer strukturen af et nøgleenzym, der fremstiller triglyceriderEt første kig på strukturen af lipin-enzymet. Strukturen viser, hvordan to væsentlige områder (farvet blå og pink), placeret på modsatte ender af proteinet hos mennesker, samles for at danne et funk
- Tre konvolutionelle neurale netværksmodeller til ansigtsudtryksgenkendelse i naturen
- Valg af de bedste funktioner til algoritmer til registrering af phishing-angreb
- Forskere opdager halvledende nanorør, der dannes spontant
- En ramme for indendørs robotnavigation blandt mennesker
- Forskere rekonstruerer sølvhandelen i Middelhavet, fra den trojanske krig til den romerske republik
- Den antropocæne signatur på Mount Elbrus, Kaukasus


