Modificerede biomaterialer samles selv på temperaturangivelser

Selvsamlede strukturer dannet af fedtsyremodificerede elastinlignende polypeptider (FAME). Forskere bruger temperatursignaler til at få molekylerne til at samle sig selv. Kredit:Davoud Mozhdehi og Kelli Luginbuhl, Duke University
Biomedicinske ingeniører fra Duke University har demonstreret en ny tilgang til fremstilling af selvsamlede biomaterialer, der er afhængig af proteinmodifikationer og temperatur. Den hybride tilgang giver forskere mulighed for at kontrollere selvsamling mere præcist, som kan vise sig nyttig til en række biomedicinske anvendelser fra lægemiddellevering til sårheling.
Undersøgelsen vises online den 19. marts i Naturkemi .
Biomaterialer har brede anvendelser på tværs af områderne vævsteknologi, regenerativ medicin og medicinafgivelse. Protein- og peptidbaserede materialer er attraktive til disse applikationer, fordi de er ikke-toksiske, biologisk nedbrydelige og har en veldefineret sammensætning. Men disse biomaterialer er begrænset til de 20 aminosyrer, der findes i naturen.
En strategi til at udvide den kemiske mangfoldighed af proteinbaserede materialer er post-translationel modifikation (PTM), et kraftfuldt sæt reaktioner, som naturen bruger til kemisk at transformere proteiner, efter at de er syntetiseret fra gener. PTM kan modificere specifikke aminosyrer i proteiner eller tilføje ikke-proteinstrukturer, såsom sukker og fedtsyrer.
"Naturen kombinerer forskellige kemiske alfabeter for at lave meget sofistikerede materialer, " sagde Ashutosh Chilkoti, formanden for BME-afdelingen hos Duke og den primære forfatter til papiret. "En måde det kan gøre dette på er ved at kombinere proteiners aminosyreordforråd med andre meget forskellige alfabeter - sukker og fedt er blot to eksempler på de mange hundrede af sådanne PTM'er. Som materialeforskere, vi har ikke udnyttet naturens metoder til at lave hybridmaterialer, og dette gav inspiration til denne forskning."
For at fremstille et sådant hybridmateriale med nyttige biomedicinske egenskaber, forskere i Chilkoti-laboratoriet fokuserede på at skabe en række lipidmodificerede polypeptider, også kaldet fedtsyre-modificerede elastin-lignende polypeptider, eller FAMEs.
Når et lipid fusioneres til en peptidsekvens, de forskellige fysiske egenskaber af lipidet og peptidet resulterer i dannelsen af peptidamfifiler, eller PA'er. Typiske PA'er kan selv samles i forskellige strukturer som lange fibre, gør dem nyttige som stilladser til vævsteknologi. Imidlertid, dette sker spontant, og disse materialer kan ikke sprøjtes ind i kroppen, men skal i stedet implanteres.
Forskerholdet tilføjede et andet nyttigt biomateriale, elastin-lignende polypeptid (ELP), fordi det kan skifte fra en opløselig tilstand til en uopløselig tilstand, eller omvendt, afhængig af temperatur.
Ved at bruge tre komponenter - en lipid myristoylgruppe, en beta-sheet-dannende peptidsekvens, og et elastin-lignende polypeptid (ELP) - forskerne skabte et hybrid biomateriale, FAME polypeptidet, der ændrer sig fra molekyler, der flyder i opløsning til et fast materiale, blot ved at hæve temperaturen.
"Vedhæftning af lipider til kort sekvens af peptider, typisk 5-20 aminosyrer, har været undersøgt i mange år, men at kombinere store biopolymerer med lipider var ikke blevet undersøgt, " sagde Davoud Mozhdehi, en postdoc i Chilkoti-laboratoriet. "Det, der adskiller FAMEs fra PA'er, er tilstedeværelsen af denne temperaturfølsomme biopolymer med meget længere længde, typisk 200-600 aminosyrer, i form af ELP."
"Den korte beta-ark-dannende peptidsekvens udgør kun omkring to procent af hele sekvensen, " sagde Mozhdehi. "Men det har en enorm indflydelse på selvsamlingsadfærden. Dette hybridmateriale bevarer ELP'ens termiske reaktionsevne og PA'ens hierarkiske selvsamling, skabe et unikt materiale med programmerbar adfærd."
"Ved at kombinere en PA med en ELP, vi får et molekyle, der kan gå fra væske til fast stof på få sekunder med en lille temperaturstigning", sagde Chilkoti. "Dette åbner op for nye applikationer inden for medicin, hvor disse materialer kan injiceres som en væske, der derefter ville blive til fast stof inde i kroppen."
Dette proof-of-concept bygger på tidligere forskning fra Chilkoti-laboratoriet, hvor forskerne udforskede nye måder at bruge enzymer til at syntetisere hybrid lipid-peptid-polymerfusioner mellem ELP'er og lipider ved hjælp af E. coli-bakterier.
"Andre havde tidligere fundet ud af, at man kan tage et specifikt enzym ud af komplekse eukaryote celler og få det til at fungere i E. coli, " sagde Kelli Luginbuhl, en forsker i Chilkoti-laboratoriet. "Normalt, dette enzym binder permanent en lipidgruppe til et protein, og vi var nysgerrige om vi kunne bruge enzymet til at lave lipid-biopolymer hybridmaterialer. Da Davoud Mozhdehi hørte om dette projekt, han havde en idé om at inkorporere en kort strukturstyrende peptidsekvens i blandingen."
Forskere ved Max Planck Institute for Polymer Research hjalp Duke-holdet ved at færdiggøre avanceret materialekarakterisering. "Efter at have hørt om de mange strukturer, der dannes af disse biofremstillede polymerer, vi var ret spændte på at deltage i dette samarbejdsprojekt for yderligere at belyse mekanismen for temperaturudløst hydrogel og aggregatdannelse i disse materialer, " sagde Max Planck-teamet i en erklæring. "Vores bidrag af temperaturafhængige, Atomkraftmikroskopi med høj opløsning og temperaturafhængig spektroskopi komplementerede arbejdet fra Duke-gruppen fint, og sammen var vi i stand til at dechifrere de molekylære transformationer, hvorved disse unikke biopolymerer danner hierarkiske materialer."
"Disse byggesten er kendt inden for området, og nu har vi vist, at kombinere dem ved at danne kovalente bindinger, resulterer i synergistiske egenskaber og selvsamling, " sagde Mozhdehi. "Vi håber at udvide denne metode til andre lipider og proteiner og udvikle nye værktøjer og materialer til biomedicinske applikationer."
Sidste artikelSmå implantater til celler er funktionelle in vivo
Næste artikelIdentifikation af designermedicin taget af overdosispatienter
 Varme artikler
Varme artikler
-
 Dobbeltemulsioner i skummetmælk ved hjælp af minimale fødevarekvalitetsemulgatorer til fedtfattig…Forskere producerer fedtfattig cheddar, der smager ligesom de rigtige ting. Kredit:Steven Lilley/Flickr For mange af os, en ostefad efter et godt måltid er en skyldig fornøjelse. Men ny forskning
Dobbeltemulsioner i skummetmælk ved hjælp af minimale fødevarekvalitetsemulgatorer til fedtfattig…Forskere producerer fedtfattig cheddar, der smager ligesom de rigtige ting. Kredit:Steven Lilley/Flickr For mange af os, en ostefad efter et godt måltid er en skyldig fornøjelse. Men ny forskning -
 Ægg-osmose-eksperimenter med destilleret vand og saltvandOsmose sker, når et opløsningsmiddel ligesom destilleret vand diffunderer over en membran til en opløsning, der har en højere koncentration af noget opløst stof, som saltvand. Æg er et modelsystem
Ægg-osmose-eksperimenter med destilleret vand og saltvandOsmose sker, når et opløsningsmiddel ligesom destilleret vand diffunderer over en membran til en opløsning, der har en højere koncentration af noget opløst stof, som saltvand. Æg er et modelsystem -
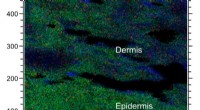 Ny metode kortlægger kemikalier i huden3-D billeddannelse af en hudsektion, hvor nikkelindholdet måles. Det røde område repræsenterer tilstedeværelsen af nikkel. Kredit:Per Malmberg En ny metode til at undersøge huden kan reducere an
Ny metode kortlægger kemikalier i huden3-D billeddannelse af en hudsektion, hvor nikkelindholdet måles. Det røde område repræsenterer tilstedeværelsen af nikkel. Kredit:Per Malmberg En ny metode til at undersøge huden kan reducere an -
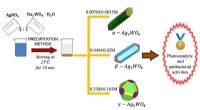 Forskere udvikler materialer til at fjerne lægemidler fra spildevandKredit:Jaume I University of Castellón Forskere fra Jaume I University of Castellón (UJI), i samarbejde med Center for Udvikling af Funktionelle Materialer (CDMF) ved Universidad Federal de São Ca
Forskere udvikler materialer til at fjerne lægemidler fra spildevandKredit:Jaume I University of Castellón Forskere fra Jaume I University of Castellón (UJI), i samarbejde med Center for Udvikling af Funktionelle Materialer (CDMF) ved Universidad Federal de São Ca
- Amerikanske demokrater afslører CO2-neutral Green New Deal
- Hubble fanger nye billeder af Jupiters nordlys
- Simulering af byer under pandemiske forhold for at komme med forudsigelser om fremtidige udbrud
- Ved hjælp af DNA -tråde til at designe nye polymermaterialer
- Grækenland forfalsket indsats mod olieudslip:miljøgrupper
- Nye løsninger til håndtering af systemiske risici


