Første af sin slags kig på den indre funktion af biologiske proteinkomplekser
Proteiner spiller en afgørende rolle i den menneskelige krop. Disse komplekse molekyler hjælper med at opretholde strukturen og funktionen af organer og væv, regulering af cellulær aktivitet på det mest fundamentale niveau.
At forstå, hvordan disse proteiner virker, kan være nøglen til at bruge dem i kampen mod sygdom – en idé, som kemikere ved University of South Florida er blevet til fremskridt.
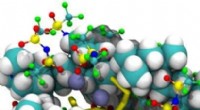
En ny undersøgelse, ledet af USF assisterende professor i kemi Ioannis Gelis, Ph.D., udgivet i Naturkommunikation , giver forskere et aldrig før set kig på den indre funktion af Hsp90-Cdc37-kinase-proteinkomplekset.
Et proteinkompleks er en gruppe af individuelle proteinmolekyler, der kommer sammen og interagerer med hinanden. Næsten enhver cellulær proces kræver, at disse komplekser dannes for at fungere korrekt. Imidlertid, i mange tilfælde, især ved tilstedeværelse af cellemutationer som hos cancerpatienter, disse komplekser kan yderligere fremme udviklingen af sygdommen.
"Hvis det lykkes os at forstå, hvordan dette molekylære maskineri fungerer, vi håber, at vi så kan udvikle nye strategier til at hæmme disse proteiner, sagde Gelis.
I proteinkomplekset studeret af USF-forskerholdet, Hsp90 og Cdc37 fungerer som chaperon eller hjælpeproteiner, hvilket betyder, at deres job er at aktivere og beskytte "klient"-proteinet, I dette tilfælde, en kinase. Når først aktiveret, kinasen letter derefter en række andre cellulære funktioner. Hos raske mennesker, det er godt. Men, for kræftceller, der bærer muterede kinaser, for eksempel, korrekt funktion af dette kompleks er dårligt, da det fremmer kræftfremgang. I det væsentlige, det beskytter kræftceller.
Gelis siger, at ideen er at stoppe disse kræftceller i at fungere, som de normalt ville. Tricket er at forhindre chaperone-proteinerne i at aktivere og beskytte klienten, lader cellens eksisterende forsvarsmekanisme naturligt nedbryde det muterede protein.
"Der er mange virksomheder og akademiske grupper, der aktivt arbejder på at udvikle inhibitorer, der ville forstyrre disse komplekser, " sagde Gelis. "Vores arbejde viser dem, hvordan dette kompleks forstyrrer under naturlige fysiologiske forhold."
Ved hjælp af nuklear magnetisk resonans (NMR) spektroskopi, Gelis og hans team var i stand til at opnå høj opløsning, tredimensionelle billeder af disse proteiner. Forskerne observerede, at tilføjelsen af kun få atomer til Cdc37 (phosphorylering), er en modifikation, der resulterer i en væsentlig strukturel ændring af proteinet. Når først den indledende fosforylering finder sted, Hsp90 oplever sin egen modifikation, som får hele komplekset til at bryde fra hinanden.
"Det er en meget indviklet og spændende mekanisme, hvorved disassociation opstår i disse komplekser, " sagde Gelis. "Den kemiske modifikation i det enestående protein er meget lille, men det medfører en enorm konformationsændring, der påvirker hele komplekset. De molekylære detaljer afsløret i vores undersøgelse bidrager til en mere omfattende forståelse af funktionen af disse proteiner og vil hjælpe med at designe bedre lægemidler til behandling af kræft."
 Varme artikler
Varme artikler
-
 En ny polymer hæver barren for lithium-svovlbatterierDenne illustration viser dannelsen af komplekse ionklynger under cyklussen af en lithium-svovl battericelle. Klyngerne består af kationiske polymerbindere, batterielektrolyt, og anioniske svovlakt
En ny polymer hæver barren for lithium-svovlbatterierDenne illustration viser dannelsen af komplekse ionklynger under cyklussen af en lithium-svovl battericelle. Klyngerne består af kationiske polymerbindere, batterielektrolyt, og anioniske svovlakt -
 Elektrisk varmeventil:Strontium cobaltoxid tynd film ændrer termiske egenskaber med påført spænd…Forskere fandt ud af, at selen cobaltoxid (SCO) naturligt forekommer i en atomart konfiguration kaldet brownmillerite (midten), men når oxygenioner tilsættes (til højre), det bliver mere velordnet og
Elektrisk varmeventil:Strontium cobaltoxid tynd film ændrer termiske egenskaber med påført spænd…Forskere fandt ud af, at selen cobaltoxid (SCO) naturligt forekommer i en atomart konfiguration kaldet brownmillerite (midten), men når oxygenioner tilsættes (til højre), det bliver mere velordnet og -
 Bæredygtig brændstof til verden:Syntetisering af ammoniak ved brug af mindre energiAmmoniak (NH3) er et af de vigtigste industrikemikalier i dag, syntetiseret globalt til brug i gødning, der derefter muliggør fødevareproduktion for cirka 70% af verdens befolkning. Ammoniak opnås i ø
Bæredygtig brændstof til verden:Syntetisering af ammoniak ved brug af mindre energiAmmoniak (NH3) er et af de vigtigste industrikemikalier i dag, syntetiseret globalt til brug i gødning, der derefter muliggør fødevareproduktion for cirka 70% af verdens befolkning. Ammoniak opnås i ø -
 Forskere finder konformationsforstyrrelser, der indstiller ladningsbærermobilitet i 2-D perovskitte…Repræsentative transiente THz -transmissionsændringer, ΔT/T, af HA2PbI4 (n =6) for forskellige excitationsfluenser (λpump =400 nm). Symboler repræsenterer eksperimentelle data, mens faste linjer passe
Forskere finder konformationsforstyrrelser, der indstiller ladningsbærermobilitet i 2-D perovskitte…Repræsentative transiente THz -transmissionsændringer, ΔT/T, af HA2PbI4 (n =6) for forskellige excitationsfluenser (λpump =400 nm). Symboler repræsenterer eksperimentelle data, mens faste linjer passe
- Hvilke faktorer påvirker frekvensen af en kemisk reaktion?
- Oksekødspeptider blokerer for bitter smag
- Hvad er forskellen mellem menneskelig og naturlig luftforurening?
- Sådan køber du soda Ash
- Kommerciel flyrejse er sikrere end nogensinde før undersøgelse finder
- Førskolelærere stiller børn for mange simple spørgsmål


