En molekylær dans af fosfolipidsyntese
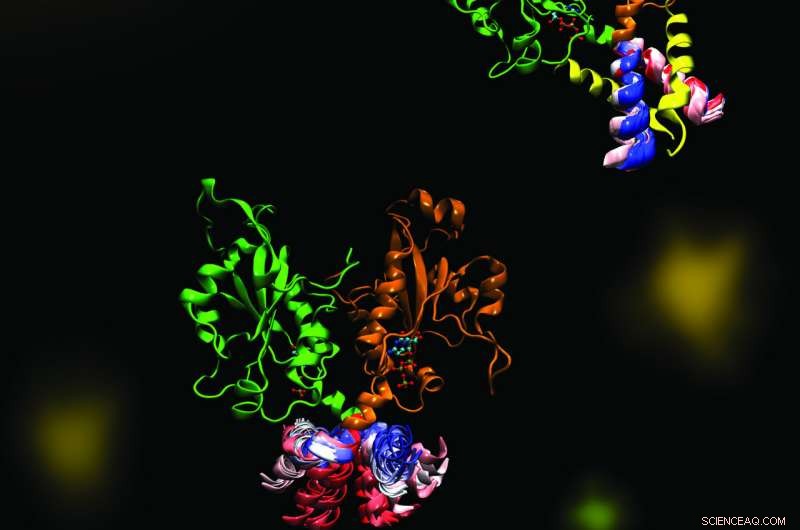
CCT er et nøgleenzym, der opretholder en afbalanceret sammensætning af cellemembranfosfolipider. Billedet fremhæver dynamikken i en del af enzymet CCT, der er afgørende for regulering af dets funktioner. Den molekylære dynamik blev udforsket i et samarbejde mellem Cornell og Tieleman laboratorierne ved hjælp af beregningsmetoder. Kredit:Mohsen Ramezanpour og Jaeyong Lee
Det mest udbredte molekyle i cellemembraner er lipidet phosphatidylcholin (PC, almindeligvis kendt som lecithin); derfor, enzymerne, der er ansvarlige for at syntetisere det, er essentielle. Forskning offentliggjort i 4. maj-udgaven af Journal of Biological Chemistry brugt computersimuleringer til at få indsigt i, hvordan et af disse enzymer aktiverer og lukker pc-produktionen fra. Disse resultater kan hjælpe forskere med at forstå, hvorfor små ændringer i dette enzym kan føre til tilstande som blindhed og dværgvækst.
Rosemary Cornell, professor i molekylær biologi og biokemi ved Simon Fraser University i Canada, studerer enzymet CTP:phosphocholin cytidylyltransferase, eller CCT. CCT sætter hastigheden for PC-produktion i celler ved at binde sig til cellemembraner med lavt PC-indhold. Når det er bundet til membraner, CCT-enzymet ændrer form på en måde, der gør det muligt for det at udføre det nøglehastighedsbegrænsende trin i pc-syntese. Når mængden af PC, der udgør membranen, stiger, CCT falder af membranen, og PC-produktionen ophører.
"Membranen er denne store makromolekylære række med masser af forskellige molekyler i sig, " sagde Cornell. "Hvordan genkender dette enzym, at 'Åh, Jeg burde sætte farten ned, fordi pc-indholdet i membranen bliver for højt?'"
Cornell og hendes projektteam - et samarbejde med Peter Tieleman og kandidatstuderende, Mohsen Ramezanpour ved University of Calgary og Jaeyong Lee og Svetla Taneva, forskningsmedarbejdere ved SFU - mente, at svaret måtte have at gøre med de dynamiske formændringer, som enzymet gennemgår, når det binder sig til en membran. Men disse ændringer er svære at fange med traditionelle strukturbiologiske metoder som røntgenkrystallografi, som tager et statisk øjebliksbillede af molekyler. I stedet, holdet brugte beregningssimuleringer af molekylær dynamik, som bruger information om kræfterne mellem hvert enkelt atom i et molekyle til at beregne banerne for enzymets bevægelige dele.
"Hvordan det ser ud (når du visualiserer outputtet), er dit store molekyle, der danser foran dine øjne, "Sagde Cornell." Vi opstillede molekylær dynamiksimulering ikke en gang, ikke to gange, men 40 forskellige (tider). Det tog måneder og måneder bare at udføre de beregningsmæssige dele og endnu flere måneder at prøve at analysere dataene bagefter. Vi brugte faktisk meget tid, da vi først fik dataene, på bare at kigge på skærmen på disse dansende molekyler."
Den simulerede dans af CCT-molekylet viste, at når M-domænet, den del af enzymet, der typisk binder til membranen, løsner sig fra en membran, det hænger enzymets aktive sted, forhindrer den i at udføre sin reaktion. Da det hængende segment blev fjernet fra simuleringen, holdet så en dramatisk bøjningsbevægelse i dockingstedet for det fastlåste element, og spekulerede i, at denne bøjning ville skabe et bedre enzym aktivt sted til katalysering af reaktionen, når den blev fæstnet til en membran. Holdet bekræftede disse mekanismer ved hjælp af biokemiske laboratorieeksperimenter.
Interessant nok, tidligere genetiske undersøgelser havde vist, at mutationer i genet, der koder for CCT, er ansvarlige for sjældne tilstande som spondylometaphyseal dysplasi med keglestangsdystrofi, som forårsager alvorlige svækkelse af knoglevækst og syn, men det var ukendt, hvordan disse ændringer i enzymet kunne føre til så dramatiske konsekvenser. Cornell håber, at forståelsen af, hvordan enzymet virker, kunne hjælpe forskerne med at finde ud af det.
"Hvis du kun har en lille ændring i CCT, hvordan vil det så gøre hele denne proces med at syntetisere pc defekt? "spørger Cornell." Det er det, vi studerer lige nu. "
 Varme artikler
Varme artikler
-
 Bakterier med metaldiæt opdaget i snavset glasManganoxidknuder genereret af bakterierne opdaget af Caltech -teamet. Noduler er generelt omkring 0,1 til 0,5 millimeter i diameter. Billeder er scanningselektronmikrofotografier med falsk farvelægnin
Bakterier med metaldiæt opdaget i snavset glasManganoxidknuder genereret af bakterierne opdaget af Caltech -teamet. Noduler er generelt omkring 0,1 til 0,5 millimeter i diameter. Billeder er scanningselektronmikrofotografier med falsk farvelægnin -
 Ortogonal reguleringsstrategi giver nye muligheder for opbygning af molekylær kompleksitetPd-katalytisk regiodivergent dimethylallylering af indazol med isopren. Kredit:JIANG Wenshuang og JI Dingwei Dimethylallyl-relaterede enheder spiller en væsentlig rolle i at øge lipofilicitet af m
Ortogonal reguleringsstrategi giver nye muligheder for opbygning af molekylær kompleksitetPd-katalytisk regiodivergent dimethylallylering af indazol med isopren. Kredit:JIANG Wenshuang og JI Dingwei Dimethylallyl-relaterede enheder spiller en væsentlig rolle i at øge lipofilicitet af m -
 Forskere udvikler billigere, hurtigere test for E. coli i drikkevandEscherichia coli. Kredit:Rocky Mountain Laboratories, NIAID, NIH Forskere ved University of Waterloo har opfundet en hurtig, overkommelig måde for udviklingssamfund at teste deres drikkevand for p
Forskere udvikler billigere, hurtigere test for E. coli i drikkevandEscherichia coli. Kredit:Rocky Mountain Laboratories, NIAID, NIH Forskere ved University of Waterloo har opfundet en hurtig, overkommelig måde for udviklingssamfund at teste deres drikkevand for p -
 Ultrasmå hule legeringsnanopartikler til synergistisk hydrogenudviklingskatalyseHER-polarisationskurverne for hule PtNiCu nanopartikler, kommerciel Pt/C, hule PtCoCu nanopartikler, hule PtCu nanopartikler og Cu nanopartikler i 1,0 M KOH vandig opløsning ved en scanningshastighed
Ultrasmå hule legeringsnanopartikler til synergistisk hydrogenudviklingskatalyseHER-polarisationskurverne for hule PtNiCu nanopartikler, kommerciel Pt/C, hule PtCoCu nanopartikler, hule PtCu nanopartikler og Cu nanopartikler i 1,0 M KOH vandig opløsning ved en scanningshastighed
- Indskrænket den nødvendige indsats for at beskytte verdens indre farvande
- Hvis astronomer ser isopren i atmosfæren i en fremmed verden, der er en god chance for, at der er l…
- Massive fotoner i et kunstigt magnetfelt
- Undersøgelsesresultater:At have et højere formål fremmer lykke, sænker stress
- Rockcyklusaktiviteter for studerende
- Søger efter de svageste påviselige magnetfelter hos hvide dværge


