Cellulær ventilstruktur åbner op for potentielle nye terapier
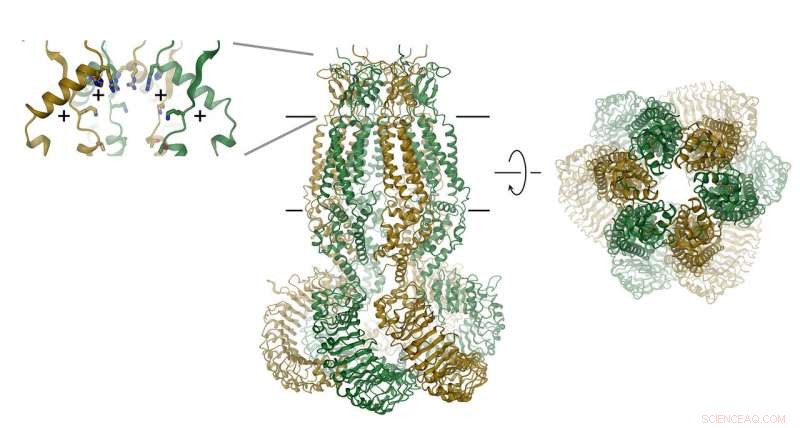
Proteinet, som består af seks underenheder, er vist som et bånd. Membranens position er angivet med linjer. Selektivitetsfilteret er afbildet som indsat (højre). Positionerne for positivt ladede aminosyrer er angivet med (+). Kredit:Raimund Dutzler, UZH
Biokemikere ved universitetet i Zürich har bestemt den detaljerede struktur for en volumenreguleret kloridkanal. Denne mobilventil aktiveres som reaktion på hævelse for at forhindre cellen i at briste. Proteinet spiller også en vigtig rolle i optagelsen af kemoterapeutika og frigivelse af neurotransmittere efter et slagtilfælde. Den kontrollerede regulering af dens aktivitet åbner således en lovende strategi for nye terapier.
Menneskelige celler er omsluttet af membraner og er i osmotisk ligevægt med deres omgivelser. Hvis koncentrationen af opløste molekyler (osmolaritet) i væsken omkring cellerne falder, cellerne begynder at hæve; i ekstreme tilfælde, dette kan resultere i, at cellerne brister. For at undgå dette, celler aktiverer volumenregulerede chloridkanaler (VRAC'er) i LRRC8-proteinfamilien. Hvis cellevolumen stiger som følge af indstrømmende vand, disse cellulære ventiler åbner for at lade de negativt ladede chloridioner og uladede osmolytter strømme ud, vende cellen tilbage til sin oprindelige tilstand.
Selvom det blev opdaget for kun fem år siden, vigtige egenskaber ved disse cellulære ventiler er allerede beskrevet. For eksempel, det vides, at udover deres rolle i volumenregulering, VRAC'er spiller en vigtig rolle for optagelsen af lægemidler, der bruges til kræftbehandling, og at de er ansvarlige for den ukontrollerede frigivelse af neurotransmittere efter et slagtilfælde. På trods af disse fremskridt, den molekylære sammensætning af VRAC'er og grundlaget for deres selektivitet er forblevet undvigende. Forskere ved Institut for Biokemi ved Zürich Universitet har nu lukket dette hul i vores forståelse. Ved hjælp af kryo-elektronmikroskopi og røntgenkrystallografi, teamet ledet af prof. Raimund Dutzler har bestemt den detaljerede molekylære struktur af en VRAC. Ud over, forskerne analyserede proteinets funktionelle egenskaber ved hjælp af elektrofysiologiske teknikker.
VRAC'er består af seks underenheder, som er arrangeret omkring en akse, der definerer ionpermeationsporen. Proteinet, som er placeret i membranen, indeholder et lille ekstracellulært og et stort intracellulært domæne. Sidstnævnte spiller sandsynligvis en vigtig rolle i kanalaktivering. Det ekstracellulære domæne begrænser kanalen og fungerer som selektivitetsfilter. "De positive rester i dette filter tiltrækker negativt ladede chloridioner og tillader deres gennemtrængning, mens de udelukker større molekyler fra at komme ind i cellen, "forklarer Raimund Dutzler.
Med deres arbejde, UZH -forskerne har givet et grundlag for en bedre forståelse af de molekylære mekanismer, der ligger til grund for cellemængderegulering. "Denne viden giver et værdifuldt grundlag for udviklingen af potentielle nye lægemidler, "siger Dutzler. I tilfælde af cerebral iskæmi eller slagtilfælde, astrocytterne i hjernen svulmer. Den resulterende ukontrollerede udstrømning af neurotransmitteren glutamat, som formidles af VRAC'er, har skadelige konsekvenser for berørte mennesker. Sådanne sager kan drage fordel af udviklingen af specifikke blokkere. En anden potentiel anvendelse vedrører VRAC'ernes rolle i kræftterapi:En cellespecifik aktivering af VRAC'er kan forbedre optagelsen af terapeutika til kræftceller.
Sidste artikelNy enhed til hurtig og præcis detektering af bly
Næste artikelMekanisk kraft styrer proteinsyntesens hastighed
 Varme artikler
Varme artikler
-
 Fra insekt til lægemiddel - skovflåtspyt kan være nøglen til behandling af hjertesygdommeKredit:Shutterstock Proteiner, der findes i flåtspyt, kan bruges til at behandle en potentielt dødelig form for hjertesygdom, ifølge ny forskning fra Oxford University. Myokarditis kan forårsage
Fra insekt til lægemiddel - skovflåtspyt kan være nøglen til behandling af hjertesygdommeKredit:Shutterstock Proteiner, der findes i flåtspyt, kan bruges til at behandle en potentielt dødelig form for hjertesygdom, ifølge ny forskning fra Oxford University. Myokarditis kan forårsage -
 Effektiv, stabilt termoelektrisk modul baseret på højtydende væskelignende materialerKredit:CC0 Public Domain Baseret på højtydende væskelignende materialer, videnskabsmænd fra Shanghai Institute of Ceramics ved det kinesiske videnskabsakademi og Northwestern University i USA frem
Effektiv, stabilt termoelektrisk modul baseret på højtydende væskelignende materialerKredit:CC0 Public Domain Baseret på højtydende væskelignende materialer, videnskabsmænd fra Shanghai Institute of Ceramics ved det kinesiske videnskabsakademi og Northwestern University i USA frem -
 Lugtende i bittesmå huse:Hvordan ciliære elektriske strømme holder olfaktionen pålideligReisert, en cellefysiolog ved Monell Center, kan lide at tackle store spørgsmål inden for olfaktorisk fysiologi. Kredit:Paola Nogueras/Monell Center Forestil dig at prøve at finde ud af, hvordan n
Lugtende i bittesmå huse:Hvordan ciliære elektriske strømme holder olfaktionen pålideligReisert, en cellefysiolog ved Monell Center, kan lide at tackle store spørgsmål inden for olfaktorisk fysiologi. Kredit:Paola Nogueras/Monell Center Forestil dig at prøve at finde ud af, hvordan n -
 Efter madlavning, bioberigede majs og æg bevarer de nødvendige næringsstoffer for at forhindre bl…Kredit:American Chemical Society Berigede og bioberigede fødevarer er på forkant med indsatsen for at bekæmpe A-vitaminmangel på verdensplan. Men lidt er kendt om, hvilken indflydelse forarbejdnin
Efter madlavning, bioberigede majs og æg bevarer de nødvendige næringsstoffer for at forhindre bl…Kredit:American Chemical Society Berigede og bioberigede fødevarer er på forkant med indsatsen for at bekæmpe A-vitaminmangel på verdensplan. Men lidt er kendt om, hvilken indflydelse forarbejdnin
- Hvordan smartphones kan bekræfte din identitet
- Ny teknik til at karakterisere kemisk sammensætning og struktur af prøver
- Nanocellulose muliggør fremstilling af nye miljøvenlige materialer
- Laboratorieforsøg viser, at halvleder nanotråde kan tunes over brede energiområder
- At finde træalternativer til truet ibenholt
- Proof-of-concept teknik gør nanopartikler attraktive for nye lægemidler


