Computer redesigner enzym

Universitetet i Groningen videnskabsmænd Dr. Hein Wijma (til venstre) og Prof. Dr. Dick B. Janssen, som brugte en ny beregningsmetode til at redesigne aspartase-enzymet og omdanne det til en katalysator for asymmetriske hydroamineringsreaktioner. Kredit:Universitetet i Groningen
Bioteknologer fra University of Groningen brugte en beregningsmetode til at redesigne aspartase og omdanne den til en katalysator for asymmetriske hydroamineringsreaktioner. Deres kolleger i Kina opskalerede produktionen af dette enzym og formåede at producere kilogram af meget rene byggesten til lægemidler og andre bioaktive forbindelser. Denne vellykkede proof-of-princip-undersøgelse blev offentliggjort i Naturens kemiske biologi den 21. maj.
Enzymer er naturlige katalysatorer, der virker under milde forhold. De er et attraktivt alternativ til ukatalyserede kemiske reaktioner, der ofte kræver energikrævende høje temperaturer eller tryk og kan generere giftige biprodukter eller bruge opløsningsmidler. Men der er et problem:Udvalget af reaktioner katalyseret af enzymer er begrænset. "Det er derfor, der bliver lagt en stor indsats i at modificere naturlige enzymer, " forklarer Dick Janssen, Professor i kemisk bioteknologi ved Groningen Biomolecular and Biotechnology Institute.
Den klassiske metode til at modificere enzymer er rettet evolution, en mutations-selektionssekvens i laboratoriet, der har til formål at skabe enzymer med modificerede katalytiske evner. Men det kræver meget arbejde at lave og teste hundredvis eller tusindvis af enzymvarianter i flere omgange. Det ville være meget mere effektivt at lave et rationelt design af de nødvendige ændringer baseret på information om enzymets struktur og egenskaber.
Men selv dette er kompliceret, forklarer Hein Wijma. Han er ekspert i molekylært designsoftware og udførte det meste af beregningsarbejdet i undersøgelsen. "Proteiner er lavet af 20 forskellige aminosyrer. Så hvis du vil ændre et enzym i fire positioner, der er 20 muligheder for hver af dem. Det resulterer i en enorm matrix af proteinstrukturer." Tester dem én efter én, selv på computeren, tager for lang tid. Imidlertid, en meget hurtig Monte Carlo-søgealgoritme fremskynder opdagelsen af det rigtige resultat ved at lede efter tendenser i enzymets reaktivitet.
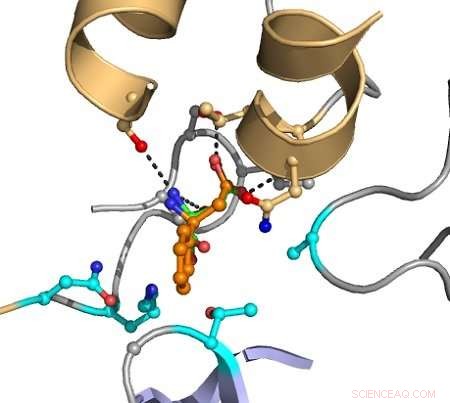
De stiplede linjer indikerer interaktioner mellem atomer, der forårsager katalyse. Målsubstratet er vist med orange, og grupperne angivet i magenta varieres i computeren for at opdage mutanter, der forbedrer omdannelsen. Kredit:Hein Wijma/University of Groningen
"Til sidst, det tog et par dage at udføre denne søgning i en dedikeret computerklynge ved universitetet i Groningen, " siger Wijma. Men der var brug for en masse modellering på forhånd. "Du skal modellere det reaktive center, lommerne, hvor substratet binder, og bestemme afstanden mellem aminosyrerne og deres relative positioner og vinkler." Da gruppen brugte et enzym (aspartase) som udgangspunkt for en række forskellige reaktioner, udgangspunktet var altid det samme. Det betød, at de kun skulle ændre målreaktionen. Wijma:"Hvis vi ville lave en ny modifikation af aspartase, det ville nok kun tage tre måneder nu."
Forskningspapiret beskriver fire konverteringer, alle tilsætninger af ammonium. Aspartase er en deaminase, så reaktionen blev vendt. "Katalyse går begge veje, så det er ikke det store problem " siger Janssen. For hver konvertering den indledende udvælgelse af algoritmen producerede omkring 100 lovende mutanter. Disse blev derefter kontrolleret for åbenlyse fejl. Janssen:"I sidste ende omkring fem til 20 mutanter blev faktisk lavet i laboratoriet og testet for at se, om de fungerede som forventet."
Det næste trin var at teste vellykkede mutante enzymer i en opskaleret indstilling. "Dette arbejde blev udført af en tidligere ph.d.-studerende og postdoc fra vores laboratorium, Bian Wu, som nu er adjunkt i Kina, " siger Janssen. "Han viste, hvilke kandidater der kunne producere store mængder af det nødvendige produkt." Substratkonverteringer på 99 procent med en 99 procent enantioselektivitet blev opnået i mængder op til et kilogram, hvilket betyder, at enzymerne forudsagt af beregningsmetoderne ser ud til at være egnede til brug i industrielle omgivelser. "Dette er et virkeligt principbevis på, at vores metode til in-silico-selektion af mutanter virker til at producere nyttige enzymer, " slutter Janssen.
 Varme artikler
Varme artikler
-
 Radioaktiv sky over Europa havde civil baggrundForskerne udførte isotopmålingerne ved hjælp af sådanne luftfiltre. Kredit:Dorian Zok/LUH En mystisk sky indeholdende radioaktivt ruthenium-106, som flyttede rundt i Europa i efteråret 2017, gener
Radioaktiv sky over Europa havde civil baggrundForskerne udførte isotopmålingerne ved hjælp af sådanne luftfiltre. Kredit:Dorian Zok/LUH En mystisk sky indeholdende radioaktivt ruthenium-106, som flyttede rundt i Europa i efteråret 2017, gener -
 Ny behandling åbner mulighed for bagning af hindbærKøbte frosne hindbær (venstre) bevarer ikke deres form eller deres saft sammenlignet med behandlede hindbær (højre). Kredit:WSU Hindbærmuffins er i vores fremtid. Forskere fra Washington State Un
Ny behandling åbner mulighed for bagning af hindbærKøbte frosne hindbær (venstre) bevarer ikke deres form eller deres saft sammenlignet med behandlede hindbær (højre). Kredit:WSU Hindbærmuffins er i vores fremtid. Forskere fra Washington State Un -
 En ny måde at vurdere mandlig fertilitet påMere sædceller bevæger sig til højre side af en central kanal, som indeholder høje koncentrationer af progesteron (mørkegrøn), end til venstre side, som indeholder lavere koncentrationer (lysegrøn). K
En ny måde at vurdere mandlig fertilitet påMere sædceller bevæger sig til højre side af en central kanal, som indeholder høje koncentrationer af progesteron (mørkegrøn), end til venstre side, som indeholder lavere koncentrationer (lysegrøn). K -
 Nyt membranvandbehandlingssystem til reducering af giftigt affald og omkostninger til bortskaffelse …Dr Adil Dhalla (venstre), Administrerende direktør for START Center, holder den nye tri-bore hulfibermembran, med Dr Antony Prince (til højre), Grundlægger af Memsift Innovations, holder det færdige m
Nyt membranvandbehandlingssystem til reducering af giftigt affald og omkostninger til bortskaffelse …Dr Adil Dhalla (venstre), Administrerende direktør for START Center, holder den nye tri-bore hulfibermembran, med Dr Antony Prince (til højre), Grundlægger af Memsift Innovations, holder det færdige m
- At arbejde hjemmefra gør os mere produktive og innovative, siger undersøgelse
- Ingeniører kan opdage ultra sjældne proteiner i blodet ved hjælp af et mobiltelefonkamera
- PNNL-teknologi baner vejen for ethanol-afledt jetbrændstof
- Ny teknik til måling af drivhusgasproduktion fra optøende permafrost
- Sådan laver du en elektrisk motor ved hjælp af et 9V-batteri
- Østlige skove formet mere af indianere, der brænder end klimaændringer


