Cryo-EM afslører interaktion mellem store lægemiddelmål
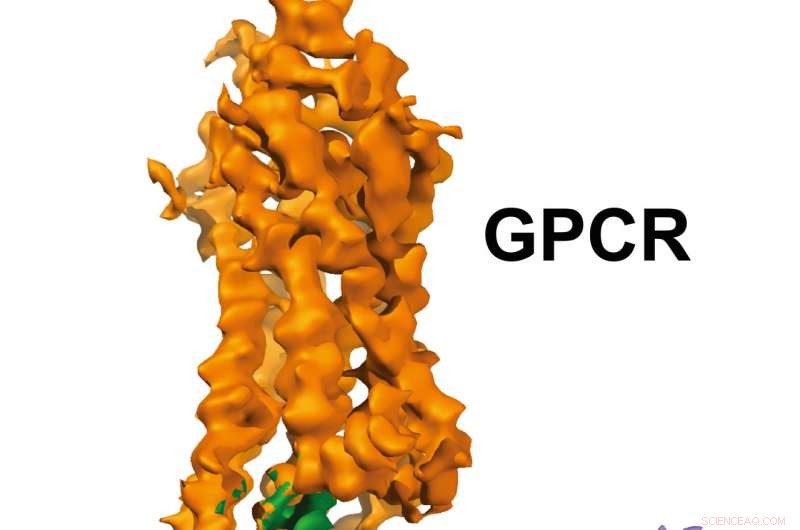
GPCR-Gi struktur. Kredit:Xu Laboratory, Van Andel Research Institute
For første gang, forskere har visualiseret interaktionen mellem to kritiske komponenter i kroppens enorme cellulære kommunikationsnetværk, en opdagelse, der kan føre til mere effektive lægemidler med færre bivirkninger for tilstande lige fra migræne til kræft.
Billeder i nærheden af atomopløsning, udgivet i dag i Natur , vise en G-proteinkoblet receptor (GPCR) kaldet rhodopsin bundet til et hæmmende G-protein, og giver en blueprint til at designe mere præcis, selektive lægemidler og samtidig løse et mangeårigt problem på området.
"Ved at visualisere dette kompleks løses et manglende kapitel i GPCR -historien ved endelig at afsløre, hvordan disse to molekyler interagerer i udsøgte detaljer, "sagde H. Eric Xu, Ph.d., en professor ved Van Andel Research Institute (VARI) og en af undersøgelsens seniorforfattere. "Alt inden for biologi er baseret på molekylære interaktioner, så jo mere vi ved om, hvordan strukturerne i disse to molekyler fungerer sammen, jo bedre position er vi til at designe forbedrede lægemidler med færre uønskede effekter. "
Dagens fund blev muliggjort ved brug af en revolutionerende teknik kaldet kryo-elektronmikroskopi (kryo-EM), som gør det muligt for forskere at se vanskelige at visualisere molekyler i overraskende klarhed.
"Brugen af cryo-EM-teknologi til at indhente strukturel information om vigtige farmaceutiske mål såsom GPCR'er i forskellige stater viser, at vi nu er i stand til at anvende disse metoder til lægemiddelopdagelsesapplikationer, "sagde Sriram Subramaniam, Ph.d., en efterforsker ved National Cancer Institute of the National Institutes of Health og en seniorforfatter af undersøgelsen.
Indlejret i cellemembranen, GPCR'er fungerer som ledninger mellem en celle og dens miljø, interagerer med G -proteiner og andre signalmolekyler kaldet arrestiner for at formidle vigtige meddelelser til og fra cellen, der regulerer et spektrum af fysiologiske funktioner, herunder vækst, immunrespons og sanseopfattelse.
Når den er forbundet med GPCR'er, hæmmende G -proteiner regulerer produktionen af sekundære kemiske budbringere, der har virkninger i hele kroppen, fra interaktioner med serotoninreceptorer i hjernen og tarmen, som hjælper med at regulere humør og appetit, til interaktioner med dopaminreceptorer i hjernen, som styrer belønningsresponser og frivillig bevægelse, blandt mange andre.
Disse omfattende interaktioner med G-proteiner og arrestiner, kombineret med deres tilgængelighed på ydersiden af cellen, gøre GPCR til attraktive mål for terapeutisk udvikling. I øjeblikket, mere end 30 procent af medicin på markedet virker ved at interagere med GPCR’er.
"Oplysningerne afsløret af vores fund vil hjælpe med at lette designet af en ny generation af medicin, "sagde Yanyong Kang, Ph.d., en forsker i Xu Laboratory og medforfatter af undersøgelsen. "Fordi dette er det første GPCR-hæmmende G-proteinkompleks, der er strukturelt bestemt, vi mener, at vores metoder vil bidrage til at karakterisere andre vigtige, endnu svære at visualisere GPCR'er. "
De 3D-billeder, der genereres af teamet, afslører en specialiseret helix for enden af det hæmmende G-protein, der fungerer som en strukturel signatur, som hjælper GPCR'er som rhodopsin med at skelne mellem hæmmende G -proteiner og en anden type G -protein kendt som et stimulerende G -protein.
Dagens resultater er de seneste i en række firsts for Xu og hans team, som inkluderer et skelsættende 2015 Natur undersøgelse, der først beskrev strukturen af rhodopsin og arrestin i kompleks sammen. Dette arbejde, der blev hyldet som et stort gennembrud på området, fik Xu Hans Neurath -prisen fra The Protein Society og Hans Neurath Foundation i 2016.
I en opfølgende undersøgelse offentliggjort i Celle i 2017, Xu og hans samarbejdspartnere forbedrede yderligere deres tidligere struktur af rhodopsin-arrestinkomplekset, og afslørede et sæt fosforyleringskoder, der dikterer samling af GPCR-arrestinkomplekser.
GPCR'er er notorisk vanskelige at visualisere ved hjælp af traditionelle røntgenkrystallografimetoder; til dato, kun 40 ud af mere end 800 GPCR'er i alt har fået deres strukturer bestemt, herunder Xus rhodopsin-arrestinkompleks.
For at bestemme dagens struktur, holdet udnyttede VARIs kraftige Titan Krios kryo-elektronmikroskop, som er i stand til at afbilde molekyler 1/10, 000. bredden af et menneskehår og kan lettere visualisere molekyler som GPCR'er, der er indlejret i cellemembranen. Instituttets Krios, som er en del af dens David Van Andel Advanced Cryo-Electron Microscopy Suite, er et af færre end 120 sådanne mikroskoper i verden.
Subramaniam og hans team har været banebrydende i brugen af cryo-EM til at bestemme nogle af de strukturer med den højeste opløsning, der hidtil er rapporteret ved hjælp af cryo-EM, herunder flere klinisk relevante ligand-proteinkomplekser.
 Varme artikler
Varme artikler
-
 Sådan finder du det halve ækvivalenspunkt i en titreringsgrafKemikere registrerer typisk resultaterne af en syretitrering på et diagram med pH på den lodrette akse og volumen på basen, de tilføjer på den vandrette akse. Dette frembringer en kurve, der stiger fo
Sådan finder du det halve ækvivalenspunkt i en titreringsgrafKemikere registrerer typisk resultaterne af en syretitrering på et diagram med pH på den lodrette akse og volumen på basen, de tilføjer på den vandrette akse. Dette frembringer en kurve, der stiger fo -
 Spytproteiner kunne forklare, hvorfor nogle mennesker bruger for meget saltKredit:American Chemical Society Mange amerikanere indtager for meget salt. Nu i en undersøgelse, der vises i Journal of Agricultural and Food Chemistry , forskere rapporterer, at mennesker, der
Spytproteiner kunne forklare, hvorfor nogle mennesker bruger for meget saltKredit:American Chemical Society Mange amerikanere indtager for meget salt. Nu i en undersøgelse, der vises i Journal of Agricultural and Food Chemistry , forskere rapporterer, at mennesker, der -
 Forskere udvikler nyt system til undersøgelse af nye krydsbårne sygdommeKredit:stock.adobe.com Krydsbårne sygdomme er stigende, og især en dukker op i USA og Canada. Human babesiose er en infektion, der kan forårsage en række symptomer og endda døden. Lidt er kendt om
Forskere udvikler nyt system til undersøgelse af nye krydsbårne sygdommeKredit:stock.adobe.com Krydsbårne sygdomme er stigende, og især en dukker op i USA og Canada. Human babesiose er en infektion, der kan forårsage en række symptomer og endda døden. Lidt er kendt om -
 Brudsejhed af materialet til flykonstruktion øges med 1,5 gangeKredit:Pixabay/CC0 Public Domain Forskere fra NUST MISIS har fundet en måde at øge brudsejheden af siliciumcarbid, et lovende konstruktionsmateriale til fremstilling af ildfaste dele, 1,5 gange.
Brudsejhed af materialet til flykonstruktion øges med 1,5 gangeKredit:Pixabay/CC0 Public Domain Forskere fra NUST MISIS har fundet en måde at øge brudsejheden af siliciumcarbid, et lovende konstruktionsmateriale til fremstilling af ildfaste dele, 1,5 gange.
- Forsker finpudser modellen til at forudsige støvede forhold måneder i forvejen
- Pattedyr længe troet uddød i Australien dukker op igen
- Oroville Dam -krisen kan være tegn på ting, der skal komme
- Kunstundervisning kan give kreative modfortællinger mod hadefulde ytringer
- Hvordan galakser dør:Ny indsigt i slukningen af stjernedannelse
- Ukonventionel superleder fungerer som en del af en lovende kvanteberegningsplatform


