Forskere tyder strukturen, hovedtræk ved et kritisk immunovervågningsprotein hos mennesker
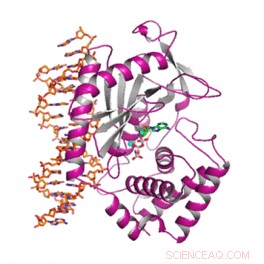
Forskere har dechiffreret de strukturelle og funktionelle forskelle mellem et kritisk humant protein, der beskytter mod kræft og bakterielle og virusinfektioner. Resultaterne forklarer, hvad der adskiller proteinets menneskelige form fra dette fra andre pattedyr. Kredit:Wen Zhou, Harvard Medical School
Menneskekroppen er bygget til overlevelse. Hver af dens celler er tæt bevogtet af et sæt immunproteiner bevæbnet med næsten idiotsikre radarer, der registrerer fremmed eller beskadiget DNA.
En af cellernes mest kritiske vagtposter er et "first responder" protein kendt som cGAS, som fornemmer tilstedeværelsen af fremmed og kræft -DNA og initierer en signalkaskade, der udløser kroppens forsvar.
Opdagelsen af cGAS i 2012 antændte en brandstorm af videnskabelig undersøgelse, resulterer i mere end 500 forskningspublikationer, men strukturen og nøgletræk ved proteinets menneskelige form fortsatte med at undvige forskere.
Nu, forskere ved Harvard Medical School og Dana-Farber Cancer Institute har, for første gang, identificerede de strukturelle og funktionelle forskelle i humant cGAS, der adskiller det fra cGAS i andre pattedyr og ligger til grund for dets unikke funktion hos mennesker.
En rapport om teamets arbejde, udgivet 12. juli i Celle , skitserer proteinets strukturelle træk, der forklarer hvorfor og hvordan humant cGAS registrerer visse typer DNA, mens man ignorerer andre.
"Strukturen og virkningsmekanismen for humant cGAS har været kritiske mangler i immunologi og kræftbiologi, sagde seniorforsker Philip Kranzusch, adjunkt i mikrobiologi og immunobiologi ved Harvard Medical School og Dana-Farber Cancer Institute. "Vores fund, der beskriver den molekylære sammensætning og funktion af humant cGAS, lukker dette kritiske hul i vores viden."
Vigtigere, resultaterne kan informere om designet af småmolekylære lægemidler, der er skræddersyet til det unikke strukturelle træk ved det humane protein-et fremskridt, der lover at øge de præcisions-cGAS-modulerende lægemidler, der i øjeblikket er under udvikling som kræftbehandling.
"Flere lovende eksperimentelle immunterapier, der er under udvikling, stammer fra musens cGAS -struktur, som rummer vigtige strukturelle forskelle med humant cGAS, "Kranzusch sagde." Vores opdagelse skulle hjælpe med at forfine disse eksperimentelle terapier og sætte gang i designet af nye. Det vil bane vejen mod strukturstyret design af lægemidler, der modulerer aktiviteten af dette fundamentale protein. "
Teamets fund forklarer en unik egenskab ved det humane protein - dets evne til at være yderst selektiv til at opdage bestemte typer DNA og dets tilbøjelighed til at blive aktiveret langt mere sparsomt, sammenlignet med cGAS -proteinet i andre dyr.
Specifikt, forskningen viser, at humant cGAS rummer mutationer, der gør det udsøgt følsomt over lange DNA -længder, men gør det "blindt" eller "ufølsomt" over for korte DNA -fragmenter.
"Human cGAS er et meget diskriminerende protein, der har udviklet forbedret specificitet over for DNA, "sagde co-første forfatter Aaron Whiteley, en postdoktor i Institut for Mikrobiologi og Immunobiologi ved Harvard Medical School. "Vores eksperimenter afslører, hvad der ligger til grund for denne evne."
Hos alle pattedyr, cGAS virker ved at detektere DNA, der er på det forkerte sted. Under normale forhold, DNA er tæt pakket og beskyttet i cellens kerne - den cellulære "sikre" - hvor genetisk information er gemt. DNA har ingen forretninger, der roaming frit rundt i cellen. Når DNA -fragmenter ender uden for kernen og i cellens cytosol, væsken, der omslutter cellens organeller, det er normalt et tegn på, at noget ildevarslende er i gang, såsom skader, der kommer inde fra cellen eller fremmed DNA fra vira eller bakterier, der har trængt ind i cellen.
CGAS -proteinet virker ved at genkende sådan malplaceret DNA. Normalt, den ligger i dvale i celler. Men så snart det fornemmer tilstedeværelsen af DNA uden for kernen, cGAS springer i aktion. Det laver et andet kemikalie - et andet budbringer - kaldet cGAMP, derved sætter gang i en molekylær kædereaktion, der advarer cellen om den unormale tilstedeværelse af DNA. Ved afslutningen af denne signalreaktion, cellen enten bliver repareret eller, hvis den er beskadiget uden reparation, det ødelægger sig selv.
Men cellens sundhed og integritet er baseret på cGAS 'evne til at skelne uskadeligt DNA fra fremmed DNA eller selv-DNA frigivet under celleskader og stress.
"Det er en fin balancegang, der holder immunsystemet i ligevægt. En overaktiv cGAS kan udløse autoimmunitet, eller selvangreb, mens cGAS, der ikke påviser fremmed DNA, kan føre til tumorvækst og kræftudvikling, sagde den første forfatter Wen Zhou, en postdoktor ved Harvard Medical School og Dana-Farber Cancer Institute.
Den nuværende undersøgelse afslører de evolutionære ændringer i proteinets struktur, der tillader menneskelig cGAS at ignorere nogle DNA -møder, mens de reagerer på andre.
For deres arbejde, holdet henvendte sig til en usandsynlig samarbejdspartner - Vibrio cholerae, bakterien, der forårsager kolera, en af menneskets ældste plage.
Udnytter et koleraenzym, der deler ligheder med cGAS, forskerne var i stand til at genskabe funktionen af både humant og mus cGAS i bakterien.
Samarbejde med kolleger fra laboratoriet fra Harvard Medical School bakteriolog John Mekalanos, forskerne designede en kimær, eller hybrid, form for cGAS, der omfattede genetisk materiale fra både menneskelige og museformer af proteinet. Derefter sammenlignede de hybrid cGAS 'evne til at genkende DNA mod både den intakte mus og intakte humane versioner af proteinet.
I en række forsøg, forskerne observerede aktiveringsmønstre mellem de forskellige typer cGAS, gradvist indsnævring af de vigtigste forskelle, der stod for differentiel DNA -aktivering blandt de tre.
Forsøgene afslørede, at ud af de 116 aminosyrer, der er forskellige i cGAS fra mennesker og mus, kun to stod for den ændrede funktion af humant cGAS. Ja, human cGAS var i stand til at genkende langt DNA med stor præcision, men det ignorerede korte DNA -fragmenter. Musversionen af proteinet, derimod, skelner ikke mellem lange og korte DNA -fragmenter
"Disse to små aminosyrer gør en verden til forskel, "Sagde Whiteley." De tillader det humane protein at være yderst selektivt og reagerer kun på langt DNA, mens man ignorerer kort DNA, i det væsentlige gør det humane protein mere tolerant over for DNA -tilstedeværelse i cellens cytosol. "
Planlægning af den genetiske divergens på en evolutionær tidsplan, videnskabsmændene fastslog, at cGAS -generne mellem mennesker og mus skiltes på et tidspunkt mellem 10 millioner og 15 millioner år siden.
De to aminosyrer, der er ansvarlige for at registrere langt DNA og tolerere kort DNA, findes udelukkende hos mennesker og ikke -menneskelige primater, såsom gorillaer, chimpanser og bonoboer.
Forskerne antager, at evnen til at ignorere kort DNA, men genkende langt DNA, må have givet nogle evolutionære fordele.
"Det kan være en måde at beskytte mod et overaktivt immunsystem og kronisk betændelse, "Kranzusch sagde." Eller det kan være, at risikoen for visse menneskelige sygdomme sænkes ved ikke at genkende kort DNA. "
I et sidste sæt eksperimenter, holdet bestemte atomstrukturen af det humane cGAS i dets aktive form, da det binder sig til DNA.
For at gøre det, they used a visualization technique known as X-ray crystallography, which reveals the molecular architecture of protein crystals based on a pattern of scattered X-ray beams.
Profiling the structure of cGAS "in action" revealed the precise molecular variations that allowed it to selectively bind to long DNA, while ignoring short DNA.
"Understanding what makes the structure and function of human cGAS different from those in other species was the missing piece, " Kranzusch said. "Now that we have it, we can really start designing drugs that work in humans, rather than mice."
 Varme artikler
Varme artikler
-
 Bimetallisk katalysator hjælper med at syntetisere justerbare iminer og sekundære aminerFigur 1. Karakterisering af bimetallisk NiCo5-katalysator. Kredit:CHEN Chun I en nylig undersøgelse, forskere fra Institute of Solid State Physics, Hefei Institutes of Physical Science forberedte
Bimetallisk katalysator hjælper med at syntetisere justerbare iminer og sekundære aminerFigur 1. Karakterisering af bimetallisk NiCo5-katalysator. Kredit:CHEN Chun I en nylig undersøgelse, forskere fra Institute of Solid State Physics, Hefei Institutes of Physical Science forberedte -
 Fladere materialer har færre ufuldkommenheder, hvilket giver bedre solceller og lyssensorerForbedring af effektiviteten af materialer vil bidrage til yderligere fremskridt inden for design og optimering af perovskit-solceller. Kredit:KAUST Forbedring af solcellernes effektivitet kræve
Fladere materialer har færre ufuldkommenheder, hvilket giver bedre solceller og lyssensorerForbedring af effektiviteten af materialer vil bidrage til yderligere fremskridt inden for design og optimering af perovskit-solceller. Kredit:KAUST Forbedring af solcellernes effektivitet kræve -
 Biologiske ingeniører finder et nyt mål for malariamedicinGrafisk abstrakt. Kredit:DOI:10.1016/j.chembiol.2021.07.010 Hvert år, mere end 200 millioner mennesker er smittet med malaria, og næsten 500, 000 dør af sygdommen. Eksisterende lægemidler kan beha
Biologiske ingeniører finder et nyt mål for malariamedicinGrafisk abstrakt. Kredit:DOI:10.1016/j.chembiol.2021.07.010 Hvert år, mere end 200 millioner mennesker er smittet med malaria, og næsten 500, 000 dør af sygdommen. Eksisterende lægemidler kan beha -
 Feltforsøg viser, at nyt katalysatormateriale til elektrolysatorer er pålideligtForskerne Emiliana Fabbri og Thomas Schmidt i et laboratorium på PSI, hvor de gennemførte eksperimenter for at studere ydelsen af den nyudviklede katalysator til elektrolysatorer. Kredit:Paul Scherr
Feltforsøg viser, at nyt katalysatormateriale til elektrolysatorer er pålideligtForskerne Emiliana Fabbri og Thomas Schmidt i et laboratorium på PSI, hvor de gennemførte eksperimenter for at studere ydelsen af den nyudviklede katalysator til elektrolysatorer. Kredit:Paul Scherr
- Svage signaler bringer budskaber fra fremtiden
- Facebook accepterer at betale bøde i Cambridge Analytica-skandalen
- Den store kommer. Her er, hvordan vi ved, og hvordan man overlever
- Apple annoncerer (PRODUCT)RED iPhone 8 og 8 Plus-modeller for at hjælpe med at bekæmpe AIDS
- MERMAIDs afslører hemmeligheder nedenunder havbunden
- Fakta om det metriske system


