Et skridt nærmere bæredygtig energi fra havvand
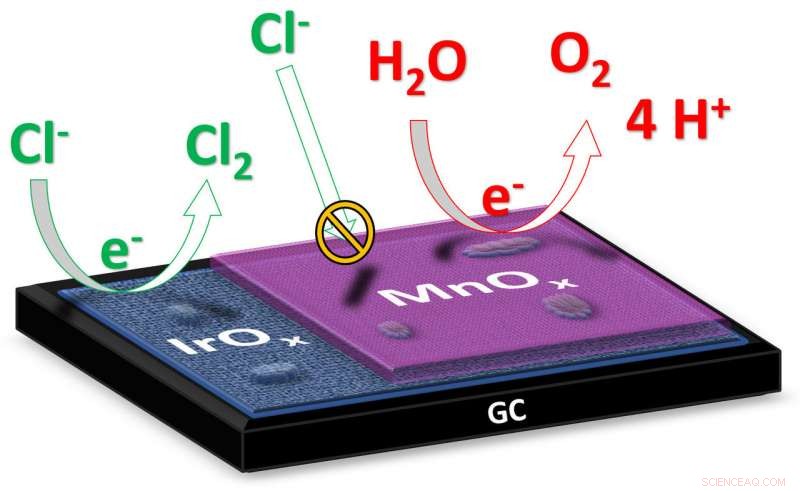
Under elektrolyse af vand, elektricitet ledes gennem vandet for at spalte det i andre stoffer. I den ønskede reaktion, flydende vand (H2O) spaltes i oxygengas (O2) og brintgas (H2). I saltvand, natriumchlorid (NaCl) er til stede som opløste natrium- og chlorioner (Na + og Cl - ). I dette tilfælde, en anden reaktion kan også forekomme under elektrolysen, hvor klorionerne omdannes til klorgas (Cl 2 ). Kredit:Leiden Universitet
Forskergruppen ledet af Leiden-kemikeren Marc Koper har opdaget en katalysator, der minimerer produktionen af klorgas under saltvandselektrolyse. Opfindelsen kan muliggøre direkte produktion af brint fra havvand. Artiklen er blevet publiceret i Journal of the American Chemical Society .
"Ved elektrolyse af saltvand, såsom havvand, det ultimative mål er at producere brint ved katoden, " forklarer ph.d.-studerende Jan Vos fra Leiden Institute of Chemistry. "Produktet dannet ved anoden er ideelt set oxygen, fordi det er uskadeligt for miljøet." under saltvandselektrolyse kan der også dannes giftig klorgas ved anoden. Forskerne har nu fremstillet en katalysator, der minimerer dannelsen af klorgas til fordel for iltdannelse. Vos forklarer:"Katalysatoren består af to metaloxider:iridiumoxid med et lag af manganoxid kun et dusin nanometer tykt. Iridium er et materiale, der udviser høj katalytisk aktivitet til dannelse af både oxygengas og klorgas; manganoxidet virker som en slags membran, der forhindrer tilførsel af kloridioner og undertrykker dannelsen af klorgas."
Elektrolysen af vand er et vigtigt skridt for produktion og anvendelse af brint som en alternativ energibærer. En anode, der modvirker dannelsen af klorgas, muliggør vandelektrolyse, hvor det ikke er nødvendigt først at rense vandet for opløst salt, hvis proces stadig koster betydelige mængder energi og kapital. Det ville tillade direkte produktion af brint fra havvand, derved aflaste de sjældne ferskvandsreserver på jorden.
Ifølge Vos, en nyttig bivirkning af saltvandselektrolyse er produktionen af meget rent ferskvand. "Hvis den udvundne brintgas i sidste ende bruges som brændstof, for eksempel i en brændselscelle i en bil, brinten reagerer tilbage til vand med iltgas fra atmosfæren. Den vej, den storstilede anvendelse af vandelektrolyse og brint i brændselsceller vil føre til store mængder af dette 'affaldsprodukt':rent vand. I en fremtid, hvor vandmangel bliver et stadig mere akut problem, dette ville bestemt ikke være uønsket."
Forskningen kaster nyt lys over et spørgsmål inden for kemi, der har stået på i årtier. "Vi havde oprindeligt ingen idé om, hvorfor materialer baseret på manganoxid havde så høj en selektivitet over for oxygen. Vi antog, at det udelukkende var en katalytisk egenskab ved materialet, men mulige virkninger af diffusionsbarrierer:den selektive blokering af transporten af chloridioner... Det kom ikke engang til at tænke på! Faktisk, det er en meget grundlæggende, effektiv løsning på et meget komplekst problem. Det har radikalt ændret vores forskningsretning."
Opdagelsen har implikationer for selektivitet i elektrolyse. Selektivitet er et vigtigt kriterium for, hvor godt en katalysator fungerer. I mange (elektro-)kemiske processer, det er muligt at danne forskellige produkter under en reaktion, men det er håbet, at kun det nødvendige produkt dannes. Måden at påvirke selektiviteten på er normalt at vælge katalysatoren meget præcist og finjustere den, men det tager meget tid og penge. I øvrigt, det er ikke altid muligt at kombinere høj selektivitet med høj aktivitet, en anden vigtig egenskab.
Ifølge Vos, forskningen passer fint ind i en spirende, alternativ tendens inden for elektrokatalyse:brugen af visse belægninger til at forbedre en katalysator. "Et sådant lag forhindrer uønskede reaktanter i at nå katalysatoren. Dette gør det muligt at gøre et aktivt, men ikke-selektivt katalytisk materiale selektivt på en alternativ måde."
 Varme artikler
Varme artikler
-
 Atomskala simulering af antiarytmisk lægemiddelinteraktion med hjertecellerAt afsløre de mystiske mekanismer for lægemiddelstyrke til behandling af hjertearytmier, UC Davis Health-forskere har udviklet nye simuleringer, der giver indsigt i vitale atom-skala lægemiddel-hjerte
Atomskala simulering af antiarytmisk lægemiddelinteraktion med hjertecellerAt afsløre de mystiske mekanismer for lægemiddelstyrke til behandling af hjertearytmier, UC Davis Health-forskere har udviklet nye simuleringer, der giver indsigt i vitale atom-skala lægemiddel-hjerte -
 Undersøgelse viser, at zinks oxidationstilstand kan laves +3, fundamentalt ændre grundstoffernes k…Kredit:Unsplash/CC0 Public Domain Zink har traditionelt en valens på to, hvilket betyder, at to elektroner deltager i grundstoffets kemiske reaktion. Et nyt papir af Virginia Commonwealth Universi
Undersøgelse viser, at zinks oxidationstilstand kan laves +3, fundamentalt ændre grundstoffernes k…Kredit:Unsplash/CC0 Public Domain Zink har traditionelt en valens på to, hvilket betyder, at to elektroner deltager i grundstoffets kemiske reaktion. Et nyt papir af Virginia Commonwealth Universi -
 Multi-tommer enkelt-krystallinsk perovskit til selvforsynet integreret kredsløb fotodetektion rappo…Tommerstørrelse perovskit-enkeltkrystaller af høj kvalitet dannet ved at undertrykke faseadskillelsen til applikationer i lysdrevne integrerede kredsløb. Kredit:DICP Perovskitter med flere katione
Multi-tommer enkelt-krystallinsk perovskit til selvforsynet integreret kredsløb fotodetektion rappo…Tommerstørrelse perovskit-enkeltkrystaller af høj kvalitet dannet ved at undertrykke faseadskillelsen til applikationer i lysdrevne integrerede kredsløb. Kredit:DICP Perovskitter med flere katione -
 Forskere konstruerer en hårdere fiberNC State University-forskere skabte fibre bestående af en galliummetalkerne omgivet af en elastisk polymerkappe. Ved stress, fiberen har styrken af metalkernen. Men når metallet går i stykker, fiber
Forskere konstruerer en hårdere fiberNC State University-forskere skabte fibre bestående af en galliummetalkerne omgivet af en elastisk polymerkappe. Ved stress, fiberen har styrken af metalkernen. Men når metallet går i stykker, fiber
- Buldrende vulkan i Indonesien kan udløse flere tsunamier, eksperter advarer
- Ny spejlbelægningsteknologi lover dramatiske forbedringer inden for teleskoper
- Ghosn ramte med flere anklager, udgivelse usandsynligt
- Professor undersøger kønsinkluderende boliger og venskaber
- NASA ser tyfonen Sanvus stort øje


