Pentagon og bønnen - tegner strukturen af et immunsystemprotein igen
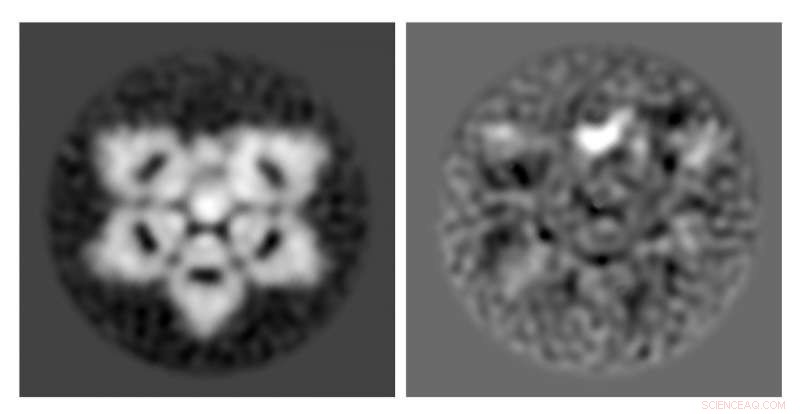
Elektronmikroskoper og moderne computerbilledbehandling tillod forskere fra University of Tokyo at afdække den korrekte struktur af et protein, der er vigtigt i immunsystemet, IgM, og et meget mindre protein, der er bundet indeni, SIGTE. IgM er den større, ufuldstændig sekskantet form og AIM er den mindre brede bønneform inde i kileformspalten. I billedet i højre side, AIM genkendes lettere som den lyse hvide, bredbønneformet plet. Kredit:Hiramoto et al., oprindeligt udgivet i Videnskab fremskridt , CC-BY
Forskere har afsløret strukturen af et vigtigt immunprotein, skabe fremtidige muligheder for at udvikle mere effektive lægemidler til en række sygdomme fra kræft til neurologiske sygdomme. Forskere fra University of Tokyo gjorde denne opdagelse med computeriseret billedanalyse og moderne elektronmikroskopisk billeddannelse.
Forskere verificerede strukturen af naturligt immunglobulin M (IgM) protein, en vigtig del af immunsystemet, ved hjælp af mus og humane versioner af proteinet. IgM forstås nu at være formet som en ufuldstændig sekskant, eller en femkant med et kileformet hul.
"Vi bliver nødt til at revidere lærebøgerne, "sagde professor Toru Miyazaki, lederen af laboratoriet, hvor IgM -strukturen blev identificeret på Graduate School of Medicine.
IgM er det første immunsystemprotein, der udvikler sig i det menneskelige foster og forbliver den første reagerer på patogener gennem hele livet. Strukturen af IgM blev først identificeret i 1969 som en "fem-spids, stjerneformet bord "og opdateret i 2009 til at være en femsidet kuppel eller" champignonhætte ".
"Den originale IgM-model blev fremstillet ved at se på et par individuelle molekyler i hånden med det, vi i dag synes er et lavopløselig mikroskop. Nu har vi klarere billeder, og computeren kan undersøge tusindvis af individuelle IgM-molekyler, "sagde Miyazaki.
Opdagelsen af den ufuldstændige sekskant i 2018 var faktisk en sekundær interesse for Miyazaki, oprindeligt en læge, der har opbygget sin forskningskarriere ved at studere et andet protein kaldet apoptosehæmmer af makrofag (AIM).
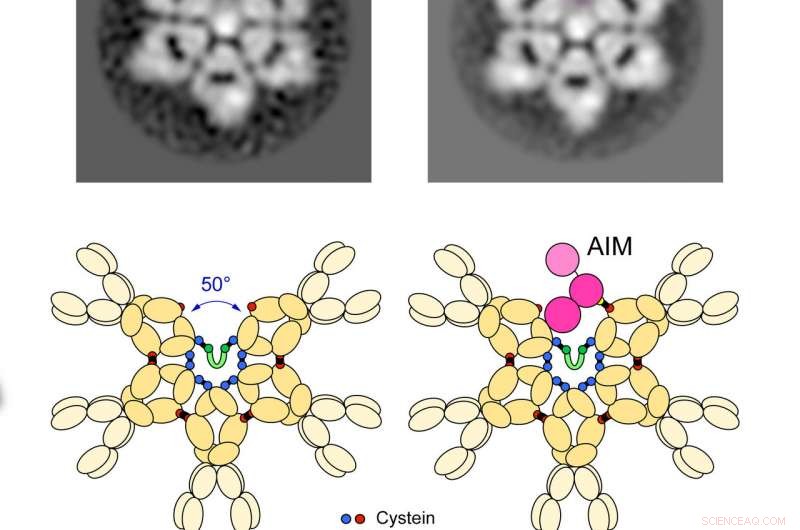
Den bona fide 2D -struktur af IgM -pentameren og dens tilknytning til AIM. Kredit:Toru Miyazaki &Satoko Arai
Siden identifikation af den korrekte form af IgM, forskere forstår nu, at inaktivt AIM ligger inde i hullet i IgM ufuldstændig sekskant. Den strukturelle forbindelse mellem IgM og AIM betyder, at lægemidler med evnen til at regulere frigivelsen af AIM kunne bruges til at skabe AIM-baserede sygdomsterapier.
"Vi kan tænke på AIM som en jagerfly og IgM som hangarskibets skib. Når andre molekyler aktiverer immunsystemet, IgM frigiver AIM. Det meget mindre AIM -protein går rundt i kroppen for at fjerne beskadigede celler og forhindre sygdom, "sagde Miyazaki.
Miyazaki identificerede AIM i 1999, mens han arbejdede på Basel Institute for Immunology Institute i Schweiz. Dens lille størrelse betyder, at AIM let elimineres fra kroppen af nyrerne og udskilles i urinen, så at forblive bundet inden for den større IgM beskytter AIM mod at blive fjernet, før det er nødvendigt.
AIM er et almindeligt molekyle i blodbanen, men den er kun aktiv, når kroppen udvikler en sygdom. AIM er kendt for at være vigtigt for at forhindre fedme, fedtsygdom hepatocellulært carcinom (leverkræft), multipel sklerose (MS), svampeinduceret peritonitis (betændelse i bugvægsmembranen), og akut nyreskade.
Den ufuldstændige sekskantstruktur er stadig kun en 2-D-forståelse af IgM-struktur. Miyazaki og hans team fortsætter med at foretage yderligere analyser og håber snart at kunne rapportere 3D-strukturen af IgM.
Sidste artikelNogle kan lide det kryogent
Næste artikelForskere viser effektiviteten af en ny ikke -invasiv blodglukosetest
 Varme artikler
Varme artikler
-
 Forskere opfinder lette flydende metalmaterialerFigur 1. GB-eGaIn. Kredit:LIU Jing Flydende metal ved stuetemperatur, for eksempel Gallium-baseret legering, har høj elektrisk og termisk ledningsevne, og fremragende flydende. De kan bruges inden
Forskere opfinder lette flydende metalmaterialerFigur 1. GB-eGaIn. Kredit:LIU Jing Flydende metal ved stuetemperatur, for eksempel Gallium-baseret legering, har høj elektrisk og termisk ledningsevne, og fremragende flydende. De kan bruges inden -
 En ny strategi for grønnere anvendelse af calciumcarbidBorn-Oppenheimer molekylær dynamik af et acetylidmolekyle HO-Ca-CCH solvatiseret i DMSO. Kredit:Mikhail Polynski, assistentlærer ved Institute of Chemistry ved St Petersburg University Calciumacet
En ny strategi for grønnere anvendelse af calciumcarbidBorn-Oppenheimer molekylær dynamik af et acetylidmolekyle HO-Ca-CCH solvatiseret i DMSO. Kredit:Mikhail Polynski, assistentlærer ved Institute of Chemistry ved St Petersburg University Calciumacet -
 Tænd logik:Ingeniører udfører beregningslogik med lysSøjleformede flydende krystaller svarer i størrelse til nuværende halvledertransistorer. Kredit:(c)2019 Aida Group For første gang, forskere har udført logiske operationer med en kemisk enhed ved
Tænd logik:Ingeniører udfører beregningslogik med lysSøjleformede flydende krystaller svarer i størrelse til nuværende halvledertransistorer. Kredit:(c)2019 Aida Group For første gang, forskere har udført logiske operationer med en kemisk enhed ved -
 Forskerteam viser komplekse, 3D-printede schwarzitter modstår tryk, når de er belagtEn komprimeringstest af 3D-printede schwarzitter, der enten er belagt eller ikke-belagt med en tynd polymer, viser, hvordan polymeren holder keramikken i stykker. Materialerne kan bruges hvor som hels
Forskerteam viser komplekse, 3D-printede schwarzitter modstår tryk, når de er belagtEn komprimeringstest af 3D-printede schwarzitter, der enten er belagt eller ikke-belagt med en tynd polymer, viser, hvordan polymeren holder keramikken i stykker. Materialerne kan bruges hvor som hels
- Evakuer eller flygtning:Hvad kalder vi mennesker fordrevet af naturkatastrofer?
- Hvordan fungerer et magnetometer?
- FCC:Mindst 1 telefonselskab brød loven ved at dele placering
- Undersøgelse finder ingen mediebias, når det kommer til valg af historie
- Røntgenpistol hjælper forskere med at identificere oprindelsen af keramik fundet på gammelt ski…
- Entropyproduktion får en systemopdatering


