Klar til nærbilledet - en bakteries elektrontransportvej
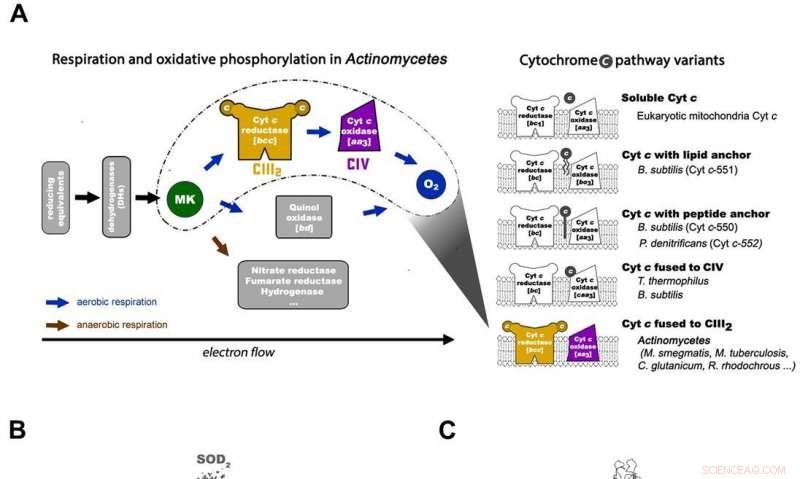
Respiration i Actinomycetes og overordnet arkitektur af Mycobacterial respiratorisk maskine CIII2CIV2SOD2. A) Den respiratoriske elektronoverførselskæde i Actinomycetes (venstre) og de 5 større prokaryote cytokrom c-vejvarianter med organisationsskemaerne i repræsentative organismer (højre). M. smegmas cytochrom c-vejen har sit cytochrom c fusioneret med kompleks III for at danne et bcc-type kompleks III, der interagerer med aa3-type kompleks IV for at samles til et CIII-CIV superkompleks. MK =menaquinon/menaquinol. B) Hele arkitekturen af bcc-aa3 type respiratorisk CIII-CIV Supercomplex fra M. smegmatis. Cryo-EM-kortet af superkomplekset viser en lineær 2-fold dimeriseret form af CIV1-CIII2-CIV1 med dimensioner 200 x 70 x 120 Å. CIII ses i orange, CIV er magenta og associationsfaktorerne PRSAF1 i grøn, LpqE i blåt og SOD i gråt. C) Tegneserierepræsentation af superkompleksets sidebillede (øverst) og et tværsnitsbillede (nederst). MK præsenteres som lyse grønne faste kugler og phospholipid som gule pinde. I tværsnitsvisningen nederst, grænserne for CIII, CIV og associationsfaktor PRSAF1 er afbildet med stiplede linjer i farve (orange for CIII, magenta for CIV og grøn for PRSAF1). Kredit: Videnskab , doi:10.1126/science.aat8923.
I en nylig undersøgelse udført af Hongri Gong og kolleger, et respiratorisk superkompleks blev isoleret fra bakterien Mycobacterium smegmatis, og dets struktur blev visualiseret ved en opløsning på 3,5 Å ved anvendelse af kryo-elektronmikroskopi (cryo-EM). Bakterien er en nær slægtning til M. tuberculosis og en populær model, der bruges til at studere mange andre bakteriearter. Den detaljerede struktur afslørede, hvordan elektroner blev overført i cellen i en hidtil uset proces.
Typisk, kemisk energi til at syntetisere adenosintrifosfat (ATP) og drive cellulære reaktioner udvindes under cellulær respiration ved at koble oxidationen af en energikilde (sukker, fedtsyrer og aminosyrer) og reduktion af en elektronacceptor (ilt, svovl, nitrat og sulfat). Ved aerob cellulær respiration, energi udvindes fra elektrondonorer til terminalacceptoren, ilt, via elektrontransportkæden (ETC) for at skabe en transmembran protongradient kendt som en protonmotive force (PMF), der driver ATP-syntese. De nye resultater er nu offentliggjort i Videnskab afsløre en direkte forbindelse til elektronoverførsel mellem enzymer for at repræsentere en ny måde for respiratorisk kædekatalyse.
Quinoner og cytokromer er to typer elektronbærere i ETC'er, der bruges til at transportere elektroner til og fra store makromolekylære strukturer indlejret i membranen. Fire membranoxidoreduktaser er involveret i den mitokondrielle respirationskæde til elektronoverførsel. Disse omfatter kompleks I (NADH:ubiquinonoxidoreduktase, CI), kompleks II (succinat:ubiquinonoxidoreduktase, CII), kompleks III (f.v.t 1 -type ubiquinol:cytokrom c oxidoreduktase, f.Kr 1 -type CIII) og kompleks IV (aa 3 -type cytochrom c oxidase, aa 3 -type CIV). Efter funktion, CIII kan oxidere ubiquinol til ubiquinon og videregive elektronerne til opløseligt cytochrom c. Elektroner sendes derefter til CIV, hvor ilt reduceres til vand. Den transmembrane PMF genereres ved protonpumpning i CI, CIII og CIV.
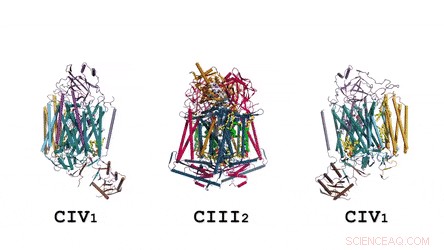
Superkompleksets arkitektur i sin helhed:Tegneseriegengivelsen viser menaquinon/menaquinol (MK) i lysegrønt farvede solide kugler og fosfolipider som gule pinde. Kredit: Videnskab , doi:10.1126/science.aat8923
I den prokaryote respirationskæde, situationen er mere kompliceret. En komplet bane for elektronstrøm er endnu ikke blevet bestemt i celletypen på grund af dens kompleksitet. Det er derfor nødvendigt at forstå den komplette struktur af et "superkompleks" involveret under bakteriel elektronoverførsel for at hjælpe målet. I undersøgelsen, forskerne udtog og rensede komplekset fra M. smegmatis for at visualisere arkitekturen ved hjælp af kryo-elektronmikroskopi (cryo-EM) ved en opløsning på 3,5 Å. Strukturen gav afgørende indsigt i mekanismen for direkte elektronoverførsel i et respiratorisk superkompleks. Dimensionerne af superkomplekset var i området 200 x 70 x 120 Å, i en symmetrisk lineær arkitektur helt forskellig fra tidligere rapporterede respiratoriske superkomplekser. Efter sammensætning, den lineære dimere CIV 1 -CIII 2 -CIV 1 blev arrangeret således, at individuelle CIV'er flankerede den centrale CIII-dimer på hver side. Oplysningerne afslørede en direkte forbindelse mellem enzymer under elektronoverførsel, repræsenterer en ny måde for respiratorisk kædekatalyse. De detaljerede strukturelle fund har potentiale til at hjælpe med bestræbelser på at opdage antimykobakterielle lægemidler.
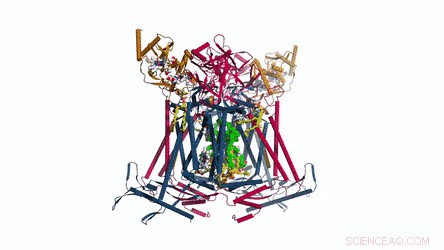
Sammensætningen og strukturen af CIII dimer. Menaquinon/menaquinol præsenteres som lysegrønne faste kugler, og fosfolipiderne er gule pinde. Kredit: Videnskab , doi:10.1126/science.aat8923
Under forsøg med bakteriecellekultur, forfatterne brugte en M. tuberculosis-lignende hydrogenperoxid-resistent M. smegmatis mutantstamme. Cellerne blev dyrket, og membranen blev isoleret som tidligere beskrevet. Efter cellekultur, høst og cellelyse, cellemembranpellets blev høstet for at ekstrahere respiratoriske superkomplekser. Superkomplekserne blev karakteriseret ved hjælp af optisk spektroskopi, massespektroskopi og 3, 3'-diaminobenzidin (DAB) farvning. For at identificere hæmgrupper, udvalgte fraktioner blev analyseret ved at optage spektre før og efter reduktion med dithionat som beskrevet tidligere. De oprensede prøver blev analyseret ved hjælp af nativ massespektroskopi for at undersøge arkitekturen, og de individuelle strukturelle komponenter blev analyseret ved hjælp af tidligere etablerede protokoller.
Under cryo-EM-analyse, forskerne brugte uranylacetat (1 procent w/v) til negativ farvning, ved at bruge 5 µl af den superkomplekse prøve i en koncentration på 0,05 mg/ml, billeder blev taget på et FEI Tecnai Spirit-mikroskop, der opererede ved 120 kV til indledende modelbygning. De opnåede billeder blev behandlet under anvendelse af en lavopløsningsrekonstruktion af superkomplekset fra 53 mikrofotografier af den negativt farvede prøve. For fuldstændig rekonstruktion af superkomplekset, forfatterne valgte manuelt 7, 600 mikrofotografier fra 8, 200 originale mikrofotografier under cryo-EM billedbehandling. Alle figurer i undersøgelsen blev skabt ved hjælp af PyMOL eller UCSF kimær.

Sammensætningen og strukturen af CIV. Tegneserie repræsentation af komplekset IV. Fosfolipiderne er vist som gule pinde. Kredit: Videnskab , doi:10.1126/science.aat8923
Forfatterne afslørede kryo-EM-strukturen af et CIII-CIV respiratorisk superkompleks af M. smegmatis-bakterierne. Den intra-komplekse elektronoverførselsvej varierede fra quinoloxidation i CIII til oxygenreduktion i CIV. Resultaterne viste en ny mekanisme til bifurcating elektronoverførsel for at sikre fuldførelse af Q-cyklussen (nettobevægelsen af protoner over et lipid-dobbeltlag) til energitransduktion. Sammenhængen af en superoxiddismutase i systemets arkitektur kan beskytte mod oxidativ beskadigelse af reaktive oxygenarter (ROS). Arkitekturen af quinonbindingssteder tilvejebragte også en ramme for fremtidige undersøgelser i strukturbaseret antimikrobiel lægemiddelopdagelse.
© 2018 Science X Network
 Varme artikler
Varme artikler
-
 Undersøgelse afslører præcis, hvordan billige brændselscellekatalysatorer fungererLos Alamos National Laboratorys Piotr Zelenay, Ted Holby og Hoon Chung. Kredit:Los ALamos National Laboratory For at reducere omkostningerne ved næste generations polymerelektrolytbrændselsceller
Undersøgelse afslører præcis, hvordan billige brændselscellekatalysatorer fungererLos Alamos National Laboratorys Piotr Zelenay, Ted Holby og Hoon Chung. Kredit:Los ALamos National Laboratory For at reducere omkostningerne ved næste generations polymerelektrolytbrændselsceller -
 Cementfri beton slår korrosion og giver fatbergs skylEt fatberg udstillet i Melbourne Museum. Kredit:Copyright Museums Victoria, Fotograf:Rob Zugaro Forskere fra RMIT University har udviklet en miljøvenlig nul-cementbeton, hvilket næsten eliminerer
Cementfri beton slår korrosion og giver fatbergs skylEt fatberg udstillet i Melbourne Museum. Kredit:Copyright Museums Victoria, Fotograf:Rob Zugaro Forskere fra RMIT University har udviklet en miljøvenlig nul-cementbeton, hvilket næsten eliminerer -
 Smeltning af skrottede enheder, da bæredygtige behov opvarmesKredit:University of Queensland Smeltning af metaller fra kasserede elektroniske enheder er blandt løsninger til bæredygtig forsyning af kritiske materialer, der undersøges af forskere fra Univers
Smeltning af skrottede enheder, da bæredygtige behov opvarmesKredit:University of Queensland Smeltning af metaller fra kasserede elektroniske enheder er blandt løsninger til bæredygtig forsyning af kritiske materialer, der undersøges af forskere fra Univers -
 Samarbejde fører til 2-D polymer opdagelseKredit:The Army Research Laboratory Hærens forskere nåede et gennembrud i den begyndende videnskab om todimensionelle polymerer takket være et samarbejdsprogram, der får hjælp fra ledende videnska
Samarbejde fører til 2-D polymer opdagelseKredit:The Army Research Laboratory Hærens forskere nåede et gennembrud i den begyndende videnskab om todimensionelle polymerer takket være et samarbejdsprogram, der får hjælp fra ledende videnska
- Mænd føler sig mindre magtfulde i deres privatliv
- Hvad er Tukey HSD Test?
- Lav dosis, konstant dryp:Farmaceutisk og personlig plejeforurening påvirker vandlevende organismer
- Undersøgelse:Meritbaseret ansættelsespraksis bidrager til kønsbestemte lønforskelle
- Forsker trækker fra fortid for at forme fremtiden for glasforskning
- Titandioxid stjerner i forskning ved Krakow synkrotron


