Selvsamlende proteinfilamenter designet og bygget fra bunden
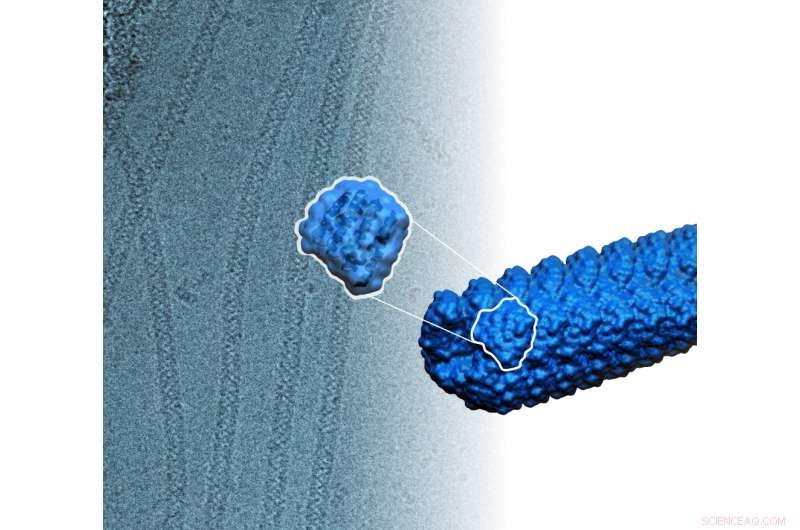
Ny, computerdesignede proteiner samler sig selv til filamenter mere end tusind gange tyndere end et menneskehår. Kredit:Ian C. Haydon/Institute for Protein Design
For første gang, videnskabsmænd har skabt, fra starten, selvsamlende proteinfilamenter.
Disse blev konstrueret af identiske proteinunderenheder, der spontant klikker sammen for at danne lange, spiralformet, trådlignende strukturer.
I den naturlige verden, proteinfilamenter er væsentlige komponenter i flere strukturelle og bevægelige dele i levende celler, samt mange kropsvæv.
Disse omfatter cytoskeletterne, der giver celler deres form, de cellulære mikrotubuli, der orkestrerer celledeling, og det mest almindelige protein i vores kroppe, kollagen, som giver både styrke og fleksibilitet til vores brusk, hud og andet væv.
"At være i stand til at skabe proteinfilamenter fra bunden - eller de novo - vil hjælpe os med bedre at forstå strukturen og mekanikken i naturligt forekommende proteinfilamenter og vil også give os mulighed for at skabe helt nye materialer, der ikke ligner nogen, der findes i naturen, " sagde David Baker, en professor i biokemi ved University of Washington School of Medicine, og direktør for UW Institute for Protein Design, hvem har ledet projektet. Han er også efterforsker ved Howard Hughes Medical Institute.
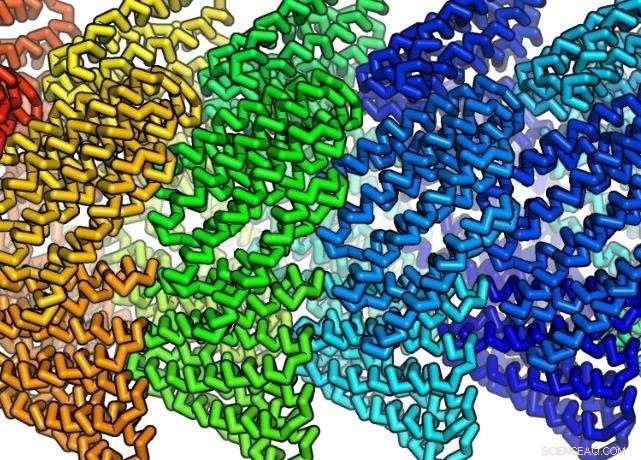
Disse nydesignede proteinkomponenter klikker spontant sammen til filamenter. De designede proteiner er relativt små, består af kun omkring 180 til 200 aminosyrer og måler kun omkring på nanometer i længden, men samles til stabile filamenter mere end 10, 000 nanometer lang. Filamenterne kan også pilles ved til enten at vokse eller skilles ad. Kredit:Institute for Protein Design/UW Medicine
Sådanne materialer kan omfatte menneskeskabte fibre, der svarer til eller overgår styrken af edderkoppesilke, som efter vægt er stærkere end stål, sagde Baker. Han nævnte også muligheden for ledningskredsløb i nanoskala.
For at designe filamenterne, forskerne brugte et computerprogram udviklet i Baker-laboratoriet, kaldet Rosetta, der kan forudsige et proteins form ud fra dets aminosyresekvens.
For at fungere korrekt, proteiner skal foldes til en præcis form. Denne foldning er drevet af egenskaber ved de enkelte aminosyrer og hvordan de interagerer med hinanden og det omgivende væskemiljø. Tiltræknings- og frastødningskræfterne driver proteinet til at hvile i en form, der har det laveste energiniveau.
Ved at beregne, hvilken form der ville balancere disse tiltræknings- og frastødningskræfter for at give det laveste totale energiniveau, Rosetta kan forudsige, med en høj grad af nøjagtighed, den form et protein vil antage i naturen.
Brug af Rosetta, forskerne satte sig for at designe små proteiner, der havde aminosyrer på deres overflade, som ville få dem til at hænge fast i hinanden. Dette gjorde det muligt for dem at samles til en helix ved at justere som trin i en snoet trappe. For at helixen skal være stabil, det designede protein binder andre kopier placeret over og under det, mens helixen snor sig rundt, etage på etage.
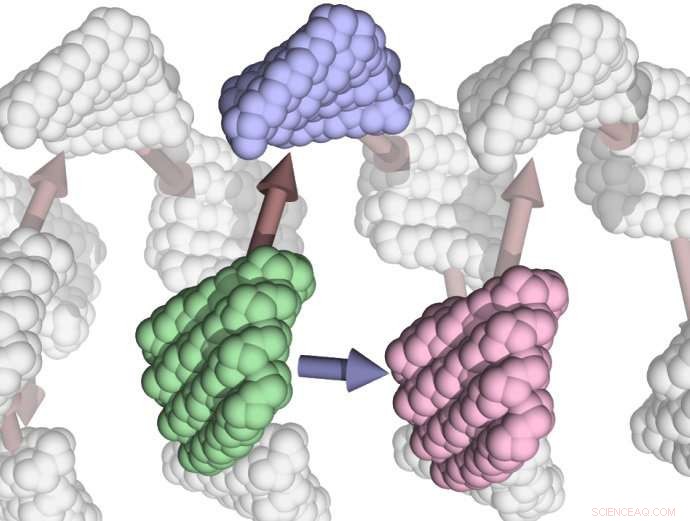
Kunstnerens idé om computerdesignede proteinenheder, der begynder at samle sig selv for at danne filamenter. Kredit:Institute for Protein Design
"Vi var i sidste ende i stand til at designe proteiner, der ville hænge sammen som legos, " sagde Hao Shen, en ph.d. kandidat ved UW Molecular Engineering &Sciences Institute. Han og Jorge Fallas, en fungerende instruktør i biokemi ved UW School of Medicine, er hovedforfattere på et papir, der beskriver tilgangen.
Denne artikel vil blive offentliggjort online af tidsskriftet Videnskab på torsdag, 8. nov., 2018.
Fallas sagde, at de designede proteiner er relativt små. De består af omkring kun 180 til 200 aminosyrer og måler kun omkring en nanometer i længden, men samles til stabile filamenter mere end 10, 000 nanometer lang. En nanometer er 1 milliardtedel af en meter, eller omkring bredden af 10 brintatomer opstillet side om side.
Forskerne viste også, at ved at pille ved det designede proteins koncentration i opløsning og ved at tilføje hætter, der hæmmede designets evne til at binde, de kunne drive filamenterne til at vokse eller skilles ad.
"Evnen til at programmere dynamikken i filamentdannelse vil give os indsigt i, hvordan filamentsamling og -demontering er reguleret i naturen, " sagde Baker. "Stabiliteten af disse proteiner tyder på, at de kunne tjene som let modificerbare stilladser til en række anvendelser lige fra nye diagnostiske test til nanoelektronik."
Sidste artikelMikroorganismer hjælper produktionen
Næste artikelFuldt identificeret - protonernes vej
 Varme artikler
Varme artikler
-
 Bluetooth-aktiveret enhed registrerer gæringsprocessen over dageBlokdiagram over multikanalpotentiostaten med seks 3-elektrode biosensorer, der producerer data, der strømmer gennem et printkort og transmitterer trådløst til et LabVIEW-interface ved hjælp af Blueto
Bluetooth-aktiveret enhed registrerer gæringsprocessen over dageBlokdiagram over multikanalpotentiostaten med seks 3-elektrode biosensorer, der producerer data, der strømmer gennem et printkort og transmitterer trådløst til et LabVIEW-interface ved hjælp af Blueto -
 Hvordan virker fotosyntese i planter?Grønne planter bruger fotosyntese til at skabe energi fra kuldioxid og sollys. Denne energi, i form af glucose, bruges af planten til at vokse og brænde plantens nødvendige reproduktive aktiviteter. O
Hvordan virker fotosyntese i planter?Grønne planter bruger fotosyntese til at skabe energi fra kuldioxid og sollys. Denne energi, i form af glucose, bruges af planten til at vokse og brænde plantens nødvendige reproduktive aktiviteter. O -
 Maskinlæring giver en genvej til at simulere interaktioner i materialer til solenergihøstMaskinlæring kan omgå eksplicit beregning af visse materialers adfærd for at accelerere simuleringer af optiske egenskaber af komplekse materialer ved endelig temperatur. Kredit:Argonne National Labor
Maskinlæring giver en genvej til at simulere interaktioner i materialer til solenergihøstMaskinlæring kan omgå eksplicit beregning af visse materialers adfærd for at accelerere simuleringer af optiske egenskaber af komplekse materialer ved endelig temperatur. Kredit:Argonne National Labor -
 Formskiftende middel er rettet mod skadelige bakterier i mavenKredit:University of Illinois i Urbana-Champaign En ny formskiftende polymer kan målrette og dræbe Helicobacter pylori-bakterier i maven uden at dræbe nyttige bakterier i tarmen. En sådan behandli
Formskiftende middel er rettet mod skadelige bakterier i mavenKredit:University of Illinois i Urbana-Champaign En ny formskiftende polymer kan målrette og dræbe Helicobacter pylori-bakterier i maven uden at dræbe nyttige bakterier i tarmen. En sådan behandli
- Træer:Den kritiske infrastruktur med lavindkomstkvarterer mangler
- Hvilken type planter og dyr lever i søer?
- Forskellige dele af et kviksølvtermometer
- Alaskas North Slope snefri sæson forlænges
- USA's hvide flertal vil snart forsvinde for altid
- Giftige kemikalier, der hindrer genopretningen af Storbritanniens floder


