AI indvarsler nye grænser til forudsigelse af enzymaktivitet
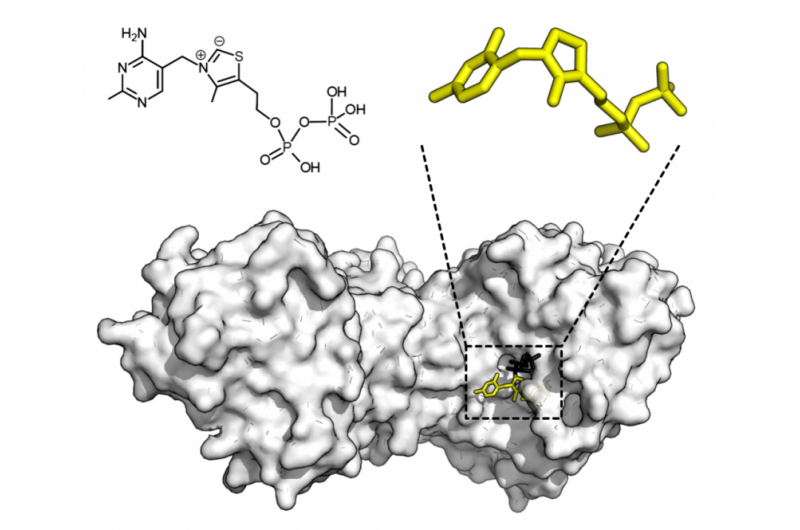
Kemisk struktur for thiaminpyrophosphat og proteinstruktur af transketolase. Thiaminpyrofosfat cofaktor i gult og xylulose 5-fosfatsubstrat i sort. Kredit:Thomas Shafee/Wikipedia
Forskere fra afdelingerne for kemi og ingeniørvidenskab ved University of Oxford har fundet en generel måde at forudsige enzymaktivitet på. Enzymer er proteinkatalysatorerne, der udfører de fleste af de centrale funktioner i biologi. Udgivet i Naturens kemiske biologi , forskernes nye AI -tilgang er baseret på enzymets sekvens, sammen med screening af et defineret 'træningssæt' af substrater og de rigtige kemiske parametre til at definere dem.
Enzymer er målet for mange lægemidler. Hvis forskere kan forudsige deres funktioner, de kan derefter hæmme disse funktioner med små molekyler - i nogle tilfælde til behandling af sygdomme. Denne forskning vil være kritisk for at skabe et holistisk billede, der giver en fyldigere og mere fuldstændig forståelse af biologi og sundhed.
Forskerne tacklede en hel familie af enzymer fra en planteart. De kombinerede ekspression af højt gennemløb af enzymerne fra de tilsvarende gener, derefter screenet deres enzymatiske aktivitet ved kvantitativ, etiketfri massespektroskopi. Enkel analyse af enzymets primære sekvens giver ikke noget reelt mønster af aktivitetsforudsigelse, men i kombination med AI -teknikker fra Oxford University's Machine Learning Group, standard kemiske deskriptorer kan udlede et stærkt forudsigeligt system.
Ben Davis, Professor i kemi ved University of Oxford siger, "Det centrale er, at denne metode frem for at være 'sort boks' giver kemikeren/biologen succesfulde forudsigelser og årsager til de forudsigelser, der har kemisk og biologisk betydning. Dette har igen givet os mulighed for at finde ud af, hvilke enzymer der kan bruges i syntese, forudsige aktiviteten af enzymer fra meget forskellige arter (selv bakterier) og for at finde ud af, hvordan man konstruerer enzymer på en ny måde baseret på forslag, som vi ikke ville have forudsagt. "
Han tilføjer:"Vi ser dette som en meget kraftfuld opdagelsesmotor. Det vil kaste spændende muligheder i blandingen til hypotesetest. I betragtning af den nylige kemi Nobelprisen i reagensglasudviklingen af enzymer, AI anvendt på enzymer for øget forståelse kan vise sig at være en meget stærk næste grænse. "
Stephen Roberts, professor i maskinlæring i informationsteknologi ved University of Oxford siger:"Vi lever i en æra med big data og store modeller, men ikke nødvendigvis af stor viden eller indsigt. Ja, arten af mange komplekse, velfungerende modeller slører detaljerne om succes, fører til 'black-box' løsninger, der mangler klar fortolkning. I skarp kontrast, den videnskabelige metode bygger indsigt ekstraktion i sin kerne. I denne forskning har vi vist, at modeller, der giver gennemsigtighed og indsigt, stadig er i stand til at drive videnskabelige fremskridt. "
Denne store fremgang muliggør vellykkede forudsigelser af proteinkatalysatoraktivitet, hvilket har betydning for en lang række områder, herunder medicinsk forskning. Det er et betydeligt mere udfordrende felt end modellering af små molekylkatalysatorer, som har været højdepunktet inden for maskinlæring/kemi indtil nu.
 Varme artikler
Varme artikler
-
 Forskere designer udvindingsmidler til sjældne jordarter ved hjælp af ny softwareKredit:Ames Laboratory U.S. Department of Energys Critical Materials Institute har udviklet et computerprogram, kaldet ParFit, som i høj grad kan reducere mængden af tid brugt på at identificere
Forskere designer udvindingsmidler til sjældne jordarter ved hjælp af ny softwareKredit:Ames Laboratory U.S. Department of Energys Critical Materials Institute har udviklet et computerprogram, kaldet ParFit, som i høj grad kan reducere mængden af tid brugt på at identificere -
 Video:Sådan spotter du falske metaller med syrerKredit:The American Chemical Society Syrer er reaktive, med selv svage syrer som eddike, der interagerer med andre materialer for at imponere eleverne. Men stærke syrer kan virkelig vise sig. For
Video:Sådan spotter du falske metaller med syrerKredit:The American Chemical Society Syrer er reaktive, med selv svage syrer som eddike, der interagerer med andre materialer for at imponere eleverne. Men stærke syrer kan virkelig vise sig. For -
 Giver brændte knogler liv igen ved hjælp af 3-D-teknologiKredit:CC0 Public Domain Retsmedicinere ved University of Portsmouth har opdaget en ny måde at præsentere skrøbelige beviser på, ved at rekonstruere et puslespil af menneskelige knoglefragmenter v
Giver brændte knogler liv igen ved hjælp af 3-D-teknologiKredit:CC0 Public Domain Retsmedicinere ved University of Portsmouth har opdaget en ny måde at præsentere skrøbelige beviser på, ved at rekonstruere et puslespil af menneskelige knoglefragmenter v -
 Selvhelbredende katalysatorer gør det lettere at lagre solenergi med vandSelvsamlingsvejen, der bruges til selvhelbredende katalysatorer. Kredit:Costentin et al. ©2017 PNAS (Phys.org) – I øjeblikket er en af de mest effektive måder at lagre solenergi på at overføre e
Selvhelbredende katalysatorer gør det lettere at lagre solenergi med vandSelvsamlingsvejen, der bruges til selvhelbredende katalysatorer. Kredit:Costentin et al. ©2017 PNAS (Phys.org) – I øjeblikket er en af de mest effektive måder at lagre solenergi på at overføre e
- Italien svulmer som Spanien, Portugal ruster til den kommende hedebølge
- Mojo Vision viser displayteknologi til augmented reality
- EU's juridiske udtalelse:massedataopbevaring i modstrid med EU-lovgivningen
- En tilgang til konstruktion af ikke-hermitiske topologiske invarianter i det virkelige rum
- Forskere skal studere virkningen af COVID-19 og social distancering på familier
- Tropical Storm Krosa får en kommaform


