Direkte udvikling af et designerenzym med en unaturlig katalytisk aminosyre
Kredit:Wiley
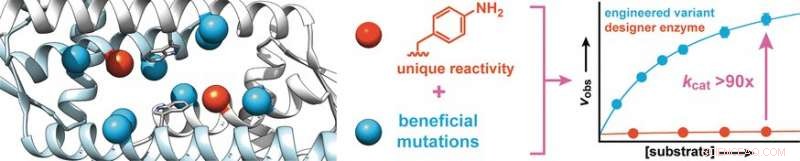
De imponerende høje omdannelsesrater af naturlige enzymer skyldes til dels at øge den katalytiske aktivitet af nogle få udvalgte aminosyresidekæder gennem præcis placering i proteinbindingshulrummet. Forskere har nu påvist, at en sådan finjustering også er mulig for "designer"-enzymer med unaturlige katalytiske aminosyrer. I journalen Angewandte Chemie , de rapporterer, at laboratorie-"evolution" af et designerenzym med en anilinsidekæde førte til varianter med signifikant højere aktivitet.
Den hastighed og selektivitet, hvormed enzymer i naturen katalyserer omdannelser, er misundelsesværdig. For katalytisk at øge unaturlige reaktioner, forskere efterligner enzymer ved hjælp af proteinrammer realiseret ved computerstøttet proteindesign. Yderligere optimering opnås ved gentagelse af en darwinistisk cyklus:1) diversificering gennem mutation, 2) identifikation af forbedrede katalysatorer, og 3) amplifikation af de mere effektive enzymvarianter. Dette giver mulighed for produktion af designerenzymer med meget høje aktiviteter.
Forskere ledet af Clemens Mayer og Gerard Roelfes ved University of Groningen (Holland) har nu påvist, at denne type rettet evolution også er en metode til at forbedre effektiviteten af en ny klasse af designerenzymer:enzymer, der indeholder en aminosyre, der er ikke udnyttet af naturen.
Startende med et protein fra Lactococcus lactis, en bakterie, der bruges til fremstilling af mejeriprodukter såsom ost og kærnemælk, forskerne syntetiserede et designerenzym, der indeholder en aminosyre med en abiotisk anilinsidekæde (aminophenylalanin). Som gratis anilin, denne aminosyre katalyserer reaktionen af aldehyder med hydraziner eller hydroxylaminer til fremstilling af hydrazoner eller oximer, henholdsvis.
For at øge enzymets aktivitet, forskerne producerede enzymvarianter med mutationer i aminosyrer nær anilinsidekæden. Screening af omkring 400 mutanter gav to kandidater med bedre aktivitet, hvoraf den ene blev udsat for en anden evolutionær runde. Dette førte til opdagelsen af mere gavnlige mutationer. For at identificere synergetiske effekter, flere gunstige mutationer blev kombineret for at producere yderligere varianter. På denne måde det var muligt at øge enzymets konverteringshastighed med en faktor 90.
Forskerne understreger, at beslægtet med naturlige enzymer, "denne drastiske stigning er baseret på at styrke den iboende katalytiske aktivitet i anilinsidekæden. Vi agter at bruge dette princip til at inkorporere yderligere organiske katalysatorer som sidekæder i enzymer, og at bruge rettet evolution til at omdanne disse til yderst effektive designerenzymer, der hurtigt og effektivt kan udføre syntetisk vigtige reaktioner, som ellers kun ville køre meget langsomt."
Sidste artikelNye materialer udviser splittet personlighed
Næste artikelMagnetiske tænder lover materialer og energi
 Varme artikler
Varme artikler
-
 Sutters biosensor kan hjælpe med at overvåge nyfødtes sundhedEn sutebiosensor kan engang bruges til ikke-invasivt at overvåge glukose i spyt hos spædbørn. Kredit:Tilpasset fra Analytisk kemi 2019, DOI:10.1021/acs.analchem.9b03379 Bærbare biosensorer, der
Sutters biosensor kan hjælpe med at overvåge nyfødtes sundhedEn sutebiosensor kan engang bruges til ikke-invasivt at overvåge glukose i spyt hos spædbørn. Kredit:Tilpasset fra Analytisk kemi 2019, DOI:10.1021/acs.analchem.9b03379 Bærbare biosensorer, der -
 Målrettet skjult lomme til behandling af slagtilfælde og anfaldEn kemisk forbindelse i 93-serien slutter sig til en neurons NMDA-receptor. Forbindelser som denne har en høj affinitet for receptoren på grund af et unikt motiv, der trækkes ind i en skjult lomme (il
Målrettet skjult lomme til behandling af slagtilfælde og anfaldEn kemisk forbindelse i 93-serien slutter sig til en neurons NMDA-receptor. Forbindelser som denne har en høj affinitet for receptoren på grund af et unikt motiv, der trækkes ind i en skjult lomme (il -
 Forskere skaber formhukommelses-aerogeler med gummilignende elasticitetTime-lapse af en aerogel, der bøjer tilbage til sin oprindelige form. Kredit:Sam OKeefe, Missouri S&T Polymere aerogeler er nanoporøse strukturer, der kombinerer nogle af de mest ønskværdige egens
Forskere skaber formhukommelses-aerogeler med gummilignende elasticitetTime-lapse af en aerogel, der bøjer tilbage til sin oprindelige form. Kredit:Sam OKeefe, Missouri S&T Polymere aerogeler er nanoporøse strukturer, der kombinerer nogle af de mest ønskværdige egens -
 Løsning af et behåret retsmedicinsk problemKredit:American Chemical Society I årtier, retsmedicinere har testet hårstrå for at afsløre stofbrug eller forgiftning. Men i de senere år, rapporter har sat spørgsmålstegn ved teknikken - især, d
Løsning af et behåret retsmedicinsk problemKredit:American Chemical Society I årtier, retsmedicinere har testet hårstrå for at afsløre stofbrug eller forgiftning. Men i de senere år, rapporter har sat spørgsmålstegn ved teknikken - især, d
- Fraktionering af DNA - fra timer til minutter
- Årsager til guld misfarvning
- Sådan skrives et gentagelses decimalt som en fraktion
- Ekstreme bølger vil blive større og hyppigere på grund af klimaændringer
- Forskere skaber rammer for evaluering af miljøstopforanstaltninger
- Voksende bioinspirerede former med hundredvis af små robotter


