Hvordan bliver proteintangles så lange ved Alzheimers?
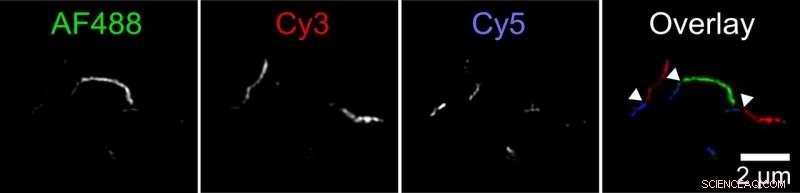
Biofysikere har opdaget en ny mekanisme, hvormed aggregater af tauprotein, kaldet fibriller, kan vokse. To fibriller kan fastgøre ende-til-ende. Denne figur viser en fibril sammensat af mindre fibriller mærket i tre farver. Forskeren mærkede tau -proteiner med tre forskellige fluorescerende farvestoffer og lod dem samle sig i separate reagensglas. Derefter blandede hun disse forskellige farvede fibriller sammen i et fjerde reagensglas. Billeder taget med et fluorescensmikroskop med superopløsning viste lange fibriller med korte sektioner af hver farve, angiver, at fibriller fra originale reagensglas skal have sammenføjede ender for at danne længere fibriller. Kredit:Carol Huseby/Ohio State University
Tidligt i løbet af Alzheimers sygdom - længe før fremtidige patienter begynder at lægge mærke til symptomer - begynder neurofibrillære sammenfiltringer sammensat af tauproteinaggregater at dannes i deres hjerneceller. Hvor giftige disse aggregater er, og hvor godt de spredes, afhænger af deres størrelse. Imidlertid, forskere, der studerer virveldannelse, har ikke været i stand til at forklare, hvorfor forskellige størrelser af kabellignende tau-aggregater forekommer i sygdom.
Men nu, forskere ved Ohio State University har opdaget, at i stedet for kun at tilføje et protein ad gangen, fibriller i forskellige længder kan slutte ende til ende for at skabe et længere filament. Fundet, som vises i Journal of Biological Chemistry på mandag, hjælper med at forklare, hvordan fibriller kan vokse til hundredvis af nanometer og kan også hjælpe forskere med at forstå mekanismer for en ny gruppe af lægemiddelkandidater designet til at hæmme tau -aggregering.
Forskere kan bruge matematiske modeller til at beskrive biologiske processer såsom fibrildannelse. En almindelig simpel model for tau -aggregering omfatter to trin. I det første trin, to tau -proteiner binder langsomt, og, i det andet trin, yderligere tau -molekyler låser hurtigt fast.
Første forfatter Carol Huseby, en kandidatstuderende i laboratoriet til Jeff Kuret, arbejder i samarbejde med Ralf Bundschuh, satte sig for at udvide denne matematiske model til at omfatte andre kendte måder, taufibriller opfører sig på. Forskere har observeret, for eksempel, at nogle gange en fibril fragmenter i to. Andre gange, en ny fibril kan nukleere midt i en eksisterende fibril.
Den enkle totrinsmodel forudsagde, at et reagensglas fyldt med renset tau-protein ville resultere i et stort antal korte fibriller. Men Huseby vidste, at når forskere ser på aggregeret tau -protein under et mikroskop, de ser et mindre antal lange fibriller. Denne uoverensstemmelse antydede, at der skete noget i den virkelige verden, som der ikke var taget højde for i modellen. De antog, at måske korte fibriller kunne fastgøre ende til ende for at blive længere.
Huseby kørte en række eksperimenter for at teste hypotesen. I en, først mærkede hun tau -proteiner med tre forskellige fluorescerende farver og lod dem samle sig i separate reagensglas. Derefter blandede hun disse forskellige farvede fibriller sammen i et fjerde reagensglas.
Billeder taget med et fluorescensmikroskop med superopløsning viste lange fibriller med korte sektioner af hver farve, angiver, at fibriller fra originale reagensglas skal have sammenføjede ender for at danne længere fibriller. Kontroleksperimenter fastslog, at dette ikke kan forklares med mærkede molekylers præference for lignende mærker.
Efter Huseby indarbejdede denne nye mekanisme i modellen, det gav en meget bedre beskrivelse af, hvad rensede tau -proteiner egentlig lavede, da de dannede aggregater. Denne undersøgelse er den første, der viser, at fibrillerne kan forlænge med mere end et enkelt tau -protein ad gangen.
Alzheimers forskere forsøger stadig at skelne mellem, om taufibriller er en årsag eller simpelthen en effekt af sygdommen. En mulighed er, at transmission af fibriller fra en celle til en anden kan bidrage til spredning af sygdom i hjernen. En meget lang fibril, ifølge Kuret, er usandsynligt at sprede sig på denne måde. "Men når det først er brudt op i små stykker, de kan sprede sig, lette deres bevægelse fra celle til celle. "
Denne undersøgelse brugte kun en type tau. Seks isoformer af forskellig længde kendes, og phosphorylering og andre ændringer øger proteinets kompleksitet. Forskerne planlægger at indarbejde disse variabler i fremtidigt arbejde, og at begynde at bruge modellen til at forstå, hvordan tau -hæmmere ændrer proteinaggregaternes adfærd.
 Varme artikler
Varme artikler
-
 Dette computerprogram gør pharma patenter lufttættehans grafiske abstrakt illustrerer, hvordan ved at identificere og holde styr på vigtige afbrydelser, der er afgørende for patentbeskyttede synteser, et retrosyntetisk computerprogram kan autonomt des
Dette computerprogram gør pharma patenter lufttættehans grafiske abstrakt illustrerer, hvordan ved at identificere og holde styr på vigtige afbrydelser, der er afgørende for patentbeskyttede synteser, et retrosyntetisk computerprogram kan autonomt des -
 Nedbrydelige elektroniske komponenter fremstillet af majsstivelseKredit:American Chemical Society Efterhånden som forbrugerne opgraderer deres gadgets i et stigende tempo, mængden af elektronisk affald, vi genererer, fortsætter med at stige. For at hjælpe med
Nedbrydelige elektroniske komponenter fremstillet af majsstivelseKredit:American Chemical Society Efterhånden som forbrugerne opgraderer deres gadgets i et stigende tempo, mængden af elektronisk affald, vi genererer, fortsætter med at stige. For at hjælpe med -
 Fremme nitrogenoxidelektroreduktion til ammoniak over elektronrigt Cu moduleret af Ru-dopingSkematisk illustration til at fremme nitrogenoxidelektroreduktion til ammoniak over ved Ru-doping. Kredit:Science China Press Som et vigtigt nitrogenholdigt kemikalie, ammoniak spiller en afgørend
Fremme nitrogenoxidelektroreduktion til ammoniak over elektronrigt Cu moduleret af Ru-dopingSkematisk illustration til at fremme nitrogenoxidelektroreduktion til ammoniak over ved Ru-doping. Kredit:Science China Press Som et vigtigt nitrogenholdigt kemikalie, ammoniak spiller en afgørend -
 En miljøvenlig metode til syntese af kanelaldehydKredit:RUDN Universitet En kemiker fra RUDN University har udviklet en økologisk sikker metode til at opnå kanelaldehyd - en forbindelse med antibakteriel og anticanceraktivitet. Forskeren brugte
En miljøvenlig metode til syntese af kanelaldehydKredit:RUDN Universitet En kemiker fra RUDN University har udviklet en økologisk sikker metode til at opnå kanelaldehyd - en forbindelse med antibakteriel og anticanceraktivitet. Forskeren brugte
- Ny teknik bruger strømanomalier til at identificere malware i integrerede systemer
- Forskere skaber nye siliciumelektroder, der forbedrer lithium-ion-batterier
- Den manglende midte:Puberteten er en kritisk tid i skolen, så hvorfor investerer vi ikke mere i det…
- Hvad får algeopblomstring til at blive giftig?
- Hvad hvis du var på en elevator, og kablet gik i stykker?
- Geolog hjælper med at bekræfte datoen for de tidligste jordplanter på Jorden


