Engineering ECM-lignende fibre med bioaktiv silke til 3-D cellekultur
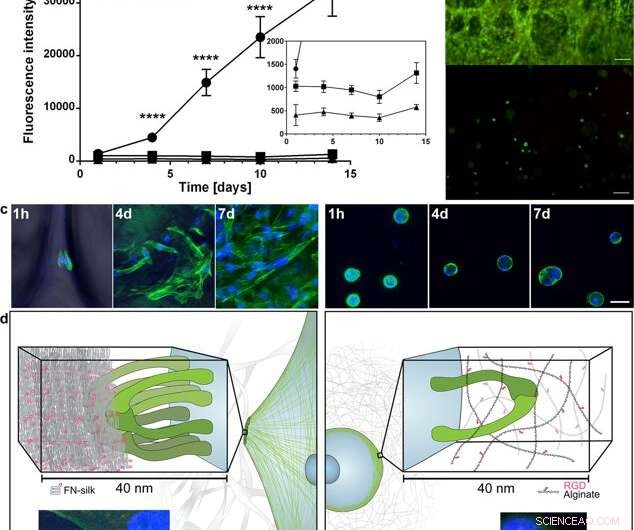
Spredning og udvidelse af celler i FN-silke sammenlignet med når de er indkapslet i en RGD-koblet hydrogel. (a) repræsentativ graf (middelværdi og standardafvigelse) for Alamar Blue-levedygtighedsassay, der viser metabolisk aktivitet af fibroblaster (HDF) inden for FN-silkeskum (cirkel), en meget lav viskositet (VLVG) alginathydrogel kombineret med RGD (kvadrat), og en medium viskositet (MVG) alginathydrogel koblet med RGD (trekant) i løbet af to ugers kultur. Indsæt viser en zoomet i betragtning af de lavere intensiteter. Statistik (studerendes t-test på hvert tidspunkt):**** angiver p <0,0001 (n =12) (b) Repræsentant levende (grøn) og død (rød) farvning af humane mesenkymale stamceller (HMSC) i FN- silkeskum (øvre) og RGD-koblet alginat VLVG (nedre) på dag 14. Skalaer =100 µm. (c) Konfokale scanninger af HMSC'er integreret i FN-silkeskum (venstre panel), og RGD -koblet alginathydrogel MVG (højre panel) efter 1 time, 4 dage og 7 dage. Actinfilamenter visualiseres ved phalloidinfarvning (grøn) og cellekerner farves med DAPI (blå). Skalaer =20 µm. (d) Skematisk beskrivelse af hypotesen af årsagen bag den observerede forskel i interaktioner mellem celler og silke (til venstre) kontra RGD-koblede alginat-hydrogeler (til højre). Flere integrinpar (grøn) kan klæbe og samle sig til silke -mikrofiberne, danner fokale adhæsioner ved kanten af aktinfilamenter, gør det muligt for cellerne at sprede sig og formere sig. I alginathydrogel, et enkelt integrinpar (grønt) kan binde til det koblede RGD-motiv, men de tynde alginatkæder begrænser efterfølgende opsamling til fokale adhæsioner. Indlæg viser eksempler på en celle (fibroblast) efter 3 timer i FN-silkeskum (venstre) og en lav viskositet (VLVG) alginathydrogel koblet med RGD (højre). Actinfilamenter visualiseres ved phalloidinfarvning (grøn), og fokale adhæsioner kan ses, hvor dette co-lokaliseres med farvning for vinculin (rød, markeret med pil). Cellekerner farves med DAPI (blå). Kredit:Videnskabelige rapporter, doi:10.1038/s41598-019-42541-y
Biologiske væv opbygges, når celler anker til bestemte steder på et 3-D mikrofibernetværk i en ekstracellulær matrix (ECM). Forskere er ivrige efter at genskabe biologiske væv i laboratoriet ved hjælp af bioinspireret vævsteknik og genteknologi, for at danne funktionelle ECM -motiver fusioneret til rekombinante silkeproteiner. Under passende fysiologiske forhold, bioingeniørfremstillede silkeproteiner og fibronectinsilke (FN-silke) kan selvsamles til mikrofibernetværk, der efterligner native ECM.
I en nylig undersøgelse, Ulrika Johansson, Mona Widhe og kolleger på de tværfaglige afdelinger inden for bioteknologi, Biomaterialer Kemi, og immunologi i Sverige udviklede en metode til at inkludere pattedyrsceller i en silkeopløsning, inden silke samles i konstruktioner, for at danne ensartede celleintegrerede vævslignende mikrofibre. De resulterende 3D-stilladskonstruktioner viste forbedret celleproliferation (vækst) og homogen cellespredning i forhold til celler indkapslet i hydrogel. Resultaterne af undersøgelsen er nu offentliggjort i Videnskabelige rapporter .
Forskerne bekræftede celleadhæsion på fibronectin-silkekonstruktioner (FN-Silk) i arbejdet ved at observere trådaktin og ved at definere fokale vedhæftningspunkter for den vedhæftede, aflange celler. De bevarede cellelevedygtighed i 90 dage i celle-FN/silkeoverfladerne og viste skalerbarhed af metoden til makro-størrelse 3-D cellekulturer. Silkemikrofiberbundterne med indkapslede celler opretholdt biomekanisk styrke og forlængelse meget ligesom menneskelige arterievægge.
Protokollen udviklet af Johansson og Widhe et al. tillod også stamceller at differentiere inde i 3D-konstruktionerne for at hjælpe væksten af forskellige cellekulturer. De viste, at endotelceller kunne inkluderes i de bioinspirerede materialer for at danne karlignende strukturer gennem vævskonstruktionerne. Forskerne forestiller sig at bruge det ECM-lignende netværk som et fundament for fremtidige bestræbelser på at konstruere funktionelle biologiske væv i laboratoriet.
In vitro pattedyrscellekultur er en uundværlig eksperimentel teknik inden for grundforskning og industrielle applikationer, selvom den eksisterende proces afhænger af 2-D hård plast eller glasoverflader for nemheds skyld-hvilket forringer det native biologiske respons. Da biologiske celler naturligt er vant til at modtage signaler fra 3D-miljøet, vævsingeniører har dannet nye eksperimentelle strategier ved hjælp af 3-D cellekulturer. De eksperimentelle betingelser opretholdt celleadhæsion, spredning og differentiering for at genskabe og opretholde cellemetabolisme og funktionalitet i laboratoriet.
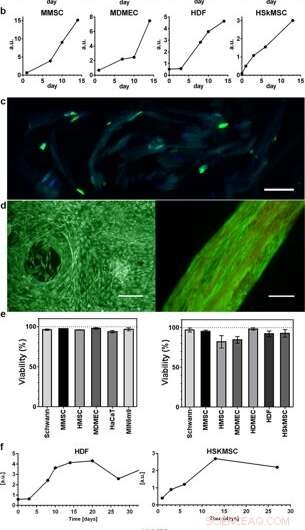
Spredning og levedygtighed af celler integreret i 3D silke. Repræsentative grafer for Alamar blue levedygtighedsassay viser stigende metabolisk aktivitet i løbet af de første 2 uger inden for (a) skum (N =3-4, n =3-7), og (b) fibre (N =1-9, n =2–13), afspejler vækst af de forskellige integrerede celletyper (HaCaT; human keratinocyt cellelinje, HDF; humane dermale fibroblaster, MDMEC; mus dermale mikrovaskulære endotelceller, MIN6m9; insulin-udskillende pankreas-p-cellelinje fra mus). (c) Celledeling sker dybt inde i 3D -silken. Kryosektion af en fiber med integrerede fibroblaster (HDF) fikseret på dag 11 og farvet med FITC-anti BrdU for nyligt syntetiseret DNA (grøn) og DAPI (blå). Silken viser en svag autofluorescens i det blå/grønne område. (d) Repræsentant levende (grøn) og død (rød) farvning af mesenkymale stamceller fra mus (MMSC) i skum (til venstre) og HDF i fiber (til højre) på dag 14. Fiberen viser en svag autofluorescens i det røde område. Målestænger =100 µm. (e) Levedygtighed (%, middel og standardafvigelse) efter 14 dages kultur af forskellige celletyper (se Suppl. tabel 1) i skum (venstre graf), og i fibre (højre graf) (N =1-3, n =4). f) Langtidskulturer af celler integreret i fibre opretholdt metabolisk aktivitet (Alamar blue) i hele undersøgelsesperioden (op til 97 dage). Kredit:Videnskabelige rapporter, doi:10.1038/s41598-019-42541-y
Tidligere har Johansson og Widhe et al. havde udviklet en skalerbar proces til at konstruere det rekombinante edderkoppesilkeprotein kendt som 4RepCT til bioinspireret cellekultur i laboratoriet, som selvsamles til bionedbrydelige og biokompatible mikrofibre i vandige, fysiologiske buffere ved stuetemperatur. De funktionaliserede den nye konstruktion ved hjælp af et celleadhæsionsmotiv fra fibronectin (FN) for at danne FN-silkematerialet og fremme fast celleadhæsion. Selvom cellerne spredte sig langs de nye materialeoverflader, de blev alene på overfladen, ude af stand til at formere sig til konstruktionerne for tilstrækkeligt at efterligne vævslignende egenskaber in vitro. I det nuværende arbejde, forskerne udviklede derfor en ny metode, for effektivt at indlejre celler i silkematerialet under samlingen af FN-silke til indkapslet og levedygtig 3-D cellekultur, der tilstrækkeligt efterlignede den ekstracellulære matrix in vitro.
Vævstekniske celleindlejrede silkekonstruktioner i laboratoriet
Under forsøgene, Johansson og Widhe et al., tilføjede først en dråbe dispergerede stamceller (mesenkymale musestamceller, MMSC) til FN-silkeproteinopløsningen før løsningsmontering. Efter inkubation, det nydannede netværk forblev stabilt i kulturmedier, og det indkapslede celleantal steg i konstruktionerne gennem hele kulturperioden. Efter tre dage, cellerne spredes over alle dimensioner af skummet, som forskerne observerede ved hjælp af differential interferens kontrast (DIC) mikroskopi.
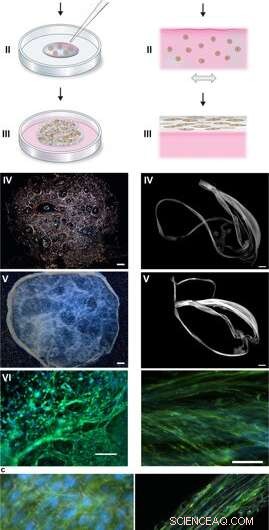
Silke-samling til at integrere celler i et 3D-netværk af mikrofibre. (a) Skematisk beskrivelse af dannelsen af silkeskum med indgroede celler. Celler suspenderet i dyrkningsmedium (pink) sættes til en defineret dråbe FN-silkeproteinopløsning (blå) placeret midt i en ikke-behandlet kulturbrønd (I). Luftbobler introduceres hurtigt (5-10 sekunder) gennem en pipettespids (II), at give anledning til et 3D -skum med celler. Efter 30 minutter i celleinkubatoren, yderligere kulturmedium tilsættes for at dække skummet fuldstændigt (III). Dag 1 efter formulering, silkeskummet med celler ser næsten gennemsigtigt ud, selvom der er nogle tilbageværende luftbobler (der forsvinder med tiden) (IV). Efter 2 ugers kultur, skummet med integrerede celler viser et tættere og hvidere udseende (V). Allerede på dag 3 er skummet fyldt med godt spredte celler (her er musens mesymale stamceller (MMSC) vist) (VI). Actinfilamenter visualiseres af phalloidin (grøn) og cellekerner ved DAPI -farvning (blå). Målestang IV-V =1 mm, VI =100 µm. (b) Skematisk beskrivelse af silkefibre dannet med integrerede celler. Celler suspenderet i medium (pink) tilsættes til FN-silkeproteinopløsningen (blå) (I). Under forsigtig gentagen enaksial vippe i 1-3 timer (II) samles silkeproteinerne ved luft-væske-grænsefladen til et makroskopisk bundt af mikrofiber med inkorporerede celler (III). Silkefibrene med celler hentes let (IV) og kan placeres i en brønd for yderligere kultur, hvorved tykkelsen stiger over 2 uger (V). På dag 3, justerede celler (her MMSC) findes spredt integreret i fiberbundtet (VI). Actinfilamenter visualiseres af phalloidin (grøn) og cellekerner ved DAPI -farvning (blå). Målestang IV-V =1 mm, VI =100 µm. (c) Differential Interference Contrast (DIC) mikrografer af silkemikrofibrene (hvide) i en fiber (venstre) og et skum (højre) med integrerede celler (MMSC). Actinfilamenter visualiseres af phalloidin (grøn) og cellekerner ved DAPI -farvning (blå). Skala bar =50 µm (venstre) og 100 µm (højre). Kredit:Videnskabelige rapporter, doi:10.1038/s41598-019-42541-y
De instruerede cellejusteringen til at danne et tilfældigt 3-D netværk af mikrofibre, der med succes efterlignede biologiske væv ved at danne et makroskopisk bundt af mikrofibre under tidslinjen for cellekultur, efterfulgt af celle til ECM ratio undersøgelse. Forskerne varierede ECM til cellesammensætning for at efterligne eller matche en række vævstyper, herunder celle sparsomme og højdensitetsvæv i leveren. Metoden er derfor også velegnet til 3-D cellekultur med små cellemængder.
Test af cellelevedygtighed på silkestilladserne - undersøgelser af cytokompatibilitet
Forskerne brugte vækstprofiler til at kortlægge de forskellige celletyper indlejret i både skum og fibre i silkesamlingen. De observerede et øget signal fra den metaboliske aktivitet for at repræsentere celleproliferation i 3D-silke stilladserne og med tiden viste de øget celletæthed i det inderste cellesilke stillads. Johansson et al. undersøgte celleproliferation ved hjælp af BrdU -farvning, hvor positive resultater viste dybere spredning og cellespredning i silkefibrene for at opretholde cellelevedygtighed efter 2 ugers indkapsling, og under langvarige cellekulturperioder, der strakte sig over en til tre måneder.
Sammenligning af cytokompatibilitet af silke vs. hydrogelbiomaterialer
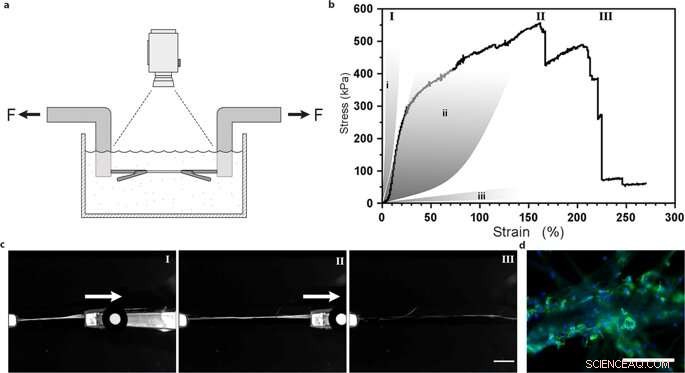
Uni-aksial trækprøvning af silkefibre med integrerede mesenkymale stamceller. (a) Illustration af den eksperimentelle opsætning til trækprøver udført i PBS-buffer ved 37 ° C for at opretholde levedygtige celler. (b) Repræsentant First Piola-Kirchhoff stress versus stamme kurve for en FN-silkefiber med integrerede mesenkymale stamceller (MMSC) underkastet trækprøvning efter 14 dages kultur. Spændings-belastningskurve illustrerer en ret lineær (og sandsynligvis elastisk) fase, der efterfølges af en plastiklignende (irreversibel) deformationsfase, indtil den maksimale spænding er nået, og fiberen går i stykker. Til sammenligning, grå områder repræsenterer spændingsegenskaber i sener og ledbånd (i), arterievægge (ii), og hjernevæv (iii). Romerske tal refererer til billeder (c) taget under trækprøvningen, dvs. under start (I), forlængelse (II) og brud (III) af fibrene. Målestang =5 mm. (d) Mikrografer af fiberens brydepunkt med MMSC'er efter trækprøvning. Actinfilamenter visualiseres ved phalloidinfarvning (grøn) og cellekerner farves med DAPI (blå). Skalaer =200 µm. Kredit:Videnskabelige rapporter, doi:10.1038/s41598-019-42541-y
Baseret på de opmuntrende foreløbige resultater, forskerne gennemførte parallelle eksperimenter for at sammenligne cellevækst i silke kontra cellevækst i hydrogel for at bestemme cytokompatibilitet af de to materialer. De valgte alginat til at repræsentere hydrogel under cellekultur og observerede forskelle mellem alginat vs silke, registrering af klar celleudvidelse i silke, mens celler i alginat forblev i en stabil metabolisk tilstand. Ved hjælp af konfokal mikroskopi, de undersøgte årsager til den observerede forskel i cellevækst på niveau med mikromiljøet. Resultaterne viste hurtig celleadhæsion (set med aflange celler) i silkekonstruktionerne, mens alginatkonstruktionerne trak sig sammen under cellekultur, som kan have stresset cellerne til at løsne sig.
Biomekaniske undersøgelser - karakterisering af de nye materialer
De bestemte, at materialets overfladestivhed var en afgørende komponent, der påvirkede celleskæbnen. For at bekræfte denne observation, Johansson et al. testet biomekanisk adfærd af silkekonstruktionerne for at sikre, at de tilstrækkeligt efterlignede naturligt væv. De udførte trækprøvning i en fysiologisk buffer for at opnå resultaterne, som beviste, at de mekaniske egenskaber af silkeholdige celler matchede bindevævs egenskaber, såsom arterielle vægge. Johansson et al. var i stand til at demonstrere høj forlængelighed af mikrofibrene for at indikere kraftovergang til og i hele cellerne, der er knyttet til det nye biomateriale - hvilket bekræfter tilstrækkelig celleadhæsion.
Biofunktionaliseringsundersøgelser - undersøgelse af overfladebiokompatibilitet in vitro
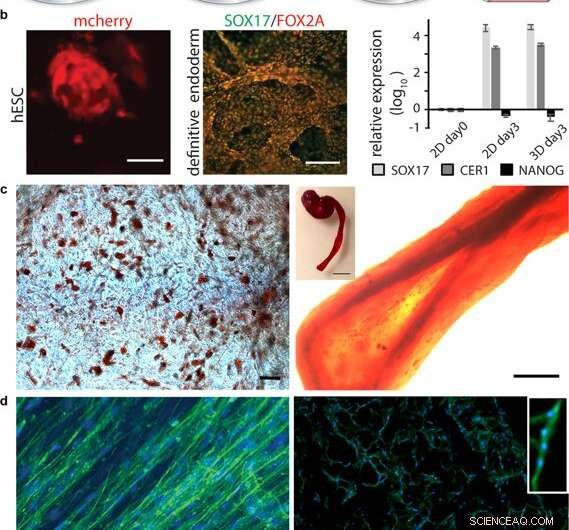
Differentiering af celler i 3D silke. (a) Efter første udvidelse af stamceller integreret i 3D -silke, differentiering til forskellige vævstyper kan udløses ved tilføjelse af passende faktorer. (b) Differentiering af pluripotente stamceller. Til venstre:Humane embryonale stamceller (hESC) visualiseret ved mCherry-detektion 48 timer efter celleintegration i FN-silkeskum. Målestang =50 µm. Midt:Immunfarvning for endodermale markører SOX17 (grøn) og FOX2A (rød) efter 3 dages differentiering. Skalaer =200 µm. Til højre:Genudtryk (SOX17, CER1, NANOG) af hESC i et FN-silkeskum sammenlignet med 2D-kultur, analyseret ved RT-qPCR på dag 3 af endodermal induktion. Søjler repræsenterer den gennemsnitlige foldændring ± standardafvigelse (n =4). (c) Differentiering af multipotente voksne stamceller. Til venstre:Humane mesenkymale stamceller (HMSC) i FN-silkeskum differentieret til den adipogene stamme indeholdende lipider, visualiseret ved rød oliefarvning (rød) (N =2, n =4). Målestang =100 µm. Til højre:HMSC'er differentieret til den osteogene slægt, sonderet med osteogen markør for calciumindhold (Alizarin Red S (rød) i FN-silkefibre (højre, skala bar =200 µm), (N =2, n =4). Indsæt viser foto af en hel fiber (højre), skala bar =1 mm). (d) Differentiering af voksne prækursorceller. Til venstre:Efter 14 dage i differentieringsmedier, skeletmuskelsatellitceller (HSkMSC) i en FN-silkefibre viser fremtrædende aktinfilamenter, som visualiseret ved phalloidin -farvning (grøn). Til højre:Myogen differentiering af skeletmuskelsatellitceller (HSkMSC) visualiseret ved Desmin -farvning (grøn). DAPI-farvede kerner i blå. (N =9, n =4). Skalaer =200 µm. Et nærbillede af området på et multinucleated myotube er vist i øverste højre hjørne. Kredit:Videnskabelige rapporter, doi:10.1038/s41598-019-42541-y
Efter at have etableret biomekanisk stabilitet, forskerne testede, om stamcellerne, der voksede på silkestilladserne, kunne differentiere (modnes) på det samme materiale. For det, de brugte pluripotente og multipotente humane embryonale stamceller i cellekulturassays, efterfulgt af kvantificering af genekspression af biologiske markører for cellevækst; FOXA2 (metaboliske gener), SOX17 (gener til embryonisk udvikling og bestemmelse af celleskæbne), CER1 (knoglemorfogenetiske proteinantagonister) og NANOG (embryonale stamcelleproliferation, pluripotens og fornyelse). I resultaterne, både SOX17 og CER1 viste robust opregulering, mens biomarkøren for pluripotens (NANOG) faldt på grund af cellemodenhed som følge af tabet af pluripotens.
Forskerne testede overfladebiofunktionalisering for forskellige celletyper, herunder menneskelige skeletmuskelsatellitceller (HSkMSC) og knoglemarvsafledte humane mesenkymale stamceller (hMSC). Efter celleudvidelse på konstruktionerne, forskerne kunne styre hMSC'ernes skæbne ind i enten adipogene eller osteogene cellelinier. Derudover efter to ugers cellekultur, Johansson et al. viste myogen differentiering af HSkMSC'erne til dannelse af fremtrædende aktinfilamenter, og udtrykke den muskelspecifikke markør desmin, for at verificere modning af myotube in vitro.
Engineering biologiske fartøjer i laboratoriet
Forskerne kombinerede derefter endotelceller i det 3D-vaskulære netværk for at danne bindevæv, der efterlignede iboende cellulær organisation af mikro-kar i laboratoriet. De fulgte den samme protokol ved hjælp af silkesamling med celleintegration og tilføjede en brøkdel af endotelceller til at konstruere bindevævet. Om to uger, de observerede cellerne samles og danner millimeter lange forgrenede spirer og karlignende strukturer med fremtrædende ringe af endotelceller i silkefibrene. Forskerne kunne øge størrelsen af konstruktionerne i skala og bestemme tilpasningen og aggregeringen af forskellige celletyper.
På denne måde, Johansson og Widhe et al. demonstreret en ny strategi og udviklet en protokol til at passe ind i funktionelle celler inden for 3-D-netværk, der efterlignede den fibrøse arkitektur i den native ekstracellulære matrix (ECM). For at formidle eksperimentet, de brugte selvsamlende rekombinante silkeproteiner og viste, at en række forskellige celler kunne indlejres i 3D-konstruktionerne. Opsætningen og protokollen er enkel og omkostningseffektiv, i modsætning til 3D-udskrivning er processen nøjsom og praktisk, uden dyre maskiner. Forskerne sigter mod at optimere og standardisere denne protokol for at udvikle biokompatibel, avancerede silkematerialer inden for vævsteknik. Det eksperimentelle arbejde vil have en bred vifte af anvendelser inden for materialevidenskab som miniature in vitro -modeller til lægemiddeludvikling og som større bioingeniørvævskonstruktioner i regenerativ medicin.
© 2019 Science X Network
 Varme artikler
Varme artikler
-
 Forskere tager skridt mod sikrere batterier ved at trimme litiumgreneSkematisk illustration af den foreslåede undertrykkende effekt af Li dendritisk vækst ved tilsætning af Mg-salt. Kredit:Royal Society of Chemistry Et samarbejdende team af forskere fra Shinshu Uni
Forskere tager skridt mod sikrere batterier ved at trimme litiumgreneSkematisk illustration af den foreslåede undertrykkende effekt af Li dendritisk vækst ved tilsætning af Mg-salt. Kredit:Royal Society of Chemistry Et samarbejdende team af forskere fra Shinshu Uni -
 Tarmbakterier er nøglen til fremstilling af universalblodKredit:Wikimedia Commons I januar, rasende storme forårsagede medicinske nødsituationer langs den amerikanske østkyst, får Røde Kors til at udsende en hasteopfordring til bloddonationer. Nationens
Tarmbakterier er nøglen til fremstilling af universalblodKredit:Wikimedia Commons I januar, rasende storme forårsagede medicinske nødsituationer langs den amerikanske østkyst, får Røde Kors til at udsende en hasteopfordring til bloddonationer. Nationens -
 Overfladeeffekt af elektroder afsløret ved operando overfladevidenskabelige metoderSkematisk af Al/HOPG planar batteri. Kredit:@Science China Press Overflade og grænseflade spiller en afgørende rolle i energilagringsenheder, kræver derfor in-situ/operando-metoder til at sonde de
Overfladeeffekt af elektroder afsløret ved operando overfladevidenskabelige metoderSkematisk af Al/HOPG planar batteri. Kredit:@Science China Press Overflade og grænseflade spiller en afgørende rolle i energilagringsenheder, kræver derfor in-situ/operando-metoder til at sonde de -
 Smart label kunne en dag fortælle dig, hvornår du skal smide mad og kosmetikSmarte etiketter til kosmetik og fødevarer kunne en dag fortælle forbrugerne, hvornår de skal smide et produkt ud. Kredit:Silvana Andreescu Detektering af mad og kosmetisk fordærv og forurening. I
Smart label kunne en dag fortælle dig, hvornår du skal smide mad og kosmetikSmarte etiketter til kosmetik og fødevarer kunne en dag fortælle forbrugerne, hvornår de skal smide et produkt ud. Kredit:Silvana Andreescu Detektering af mad og kosmetisk fordærv og forurening. I
- Rulning af terninger til cellestørrelsesspecifikation i planteblad epidermis
- Dele af en Bunsen-brænder og deres funktioner
- Gendanne jord til at håndtere klimaændringer
- Arkæologer mener, at Norges fund er en sjælden vikingeskibsbegravelse
- Fra modstandsdygtighed til tilpasning:Sagen om orkaner
- Hvorfor kinesisk videnskab virker så hemmelighedsfuld – og hvordan den kan være ved at ændre sig


