Virulensfaktor for influenza A-virus kortlagt i realtid
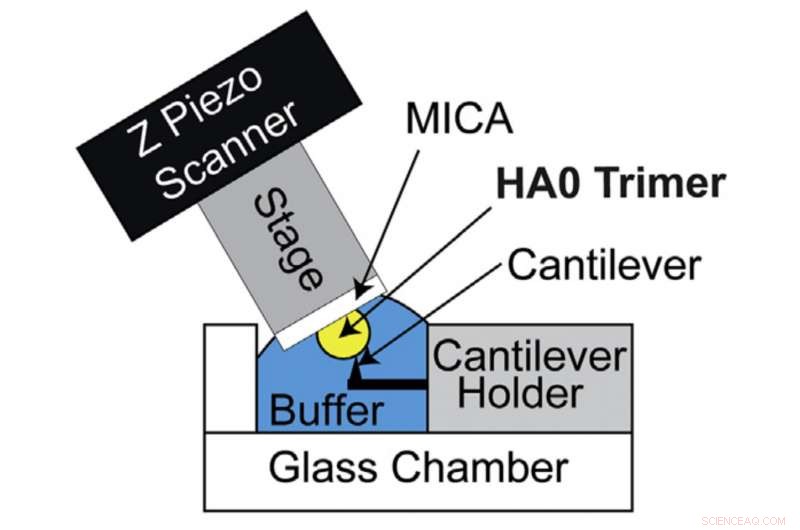
HS-AFM opsætning til direkte visualisering af HA0 trimer. Skematisk diagram over HS-AFM-opsætningen til scanning af HA0-trimeren. Kredit:Kanazawa University
Influenza A -vira, som tidligere er ansvarlige for dødelige pandemier, er stadig et stort globalt folkesundhedsproblem i dag. Molekyler kendt som virulensfaktorer produceres af bakterier, vira, og svampe til at hjælpe dem med at inficere værtsceller. En af virulensfaktorer, der findes i influenza A -vira, er hæmagglutinin (HA). Forskere ved Kanazawa University har for nylig undersøgt strukturen af HA af aviær influenzavirus, H5N1, ved hjælp af højhastigheds-atomkraftmikroskopi (HS-AFM). Deres fund er afgørende for at udvikle terapeutiske tilgange mod influenza A -vira i fremtiden.
HA syntetiseres indledningsvis af værtsceller i sin forstadie, kendt som HA0. Omdannelse af HA0 til HA afhænger af patogeniciteten af influenza A -vira:ekstracellulær omdannelse til lavpatogen influenza A -vira og intracellulær konvertering for stærkt patogene influenza A -vira. Derfor, forståelse af strukturen og egenskaberne af HA0 er altafgørende for at dechifrere HA. Richard Wong og hans forskerhold forsøgte således at undersøge HA0 under mikroskopet. Det rekombinante HA0-protein af H5N1 blev visuelt analyseret af HS-AFM-systemet udviklet af Kanazawa University.
Både HA0 og HA findes i homotrimeriske former, og omdannelse af HA0 til HA ændrer ikke signifikant den homotrimeriske struktur. Derfor, det er rimeligt at bruge HA som en skabelon til at generere HA0 HS-AFM simuleringsbilleder. Et surt endosomalt miljø er den kritiske faktor for HA til at fremkalde fusion mellem den virale membran og den endosomale membran for at frigive virale materialer i værtsceller. For at belyse den sure virkning på HA0, den blev først udsat for et surt miljø. Trimeren af HA0 viste sig at være meget følsom over for den sure opløsning og ekspanderede betydeligt. Når konformationelle ændringer af hæmagglutinin blev målt i realtid ved hjælp af HS-AFM, teamet fandt ud af, at dets område var større, og dens højde er kortere. Det sure miljø gjorde i det væsentlige molekylet fladere og mere cirkulært, i forhold til dens oprindelige modstykke. Denne ændring i konformation var, imidlertid, reversibel, da strukturen vendte tilbage til sin oprindelige form ved neutralisering.
Denne undersøgelse banede vejen for at undersøge biologiske begivenheder inden for vira i realtid. Forfatterne angiver betydningen af HS-AFM for denne forskning:"Vores pilotarbejde etablerer HS-AFM som et uforligneligt værktøj til direkte at studere viral proteindynamik, som er vanskelige at fange med lave signal-til-støj-teknikker, der er afhængige af ensemble-gennemsnit, såsom cyro-EM og røntgenkrystallografi, "siger hovedforfatter af undersøgelsen Dr. Kee Siang Lim." Med høj scanningshastighed og en minimalt invasiv cantilever, vi forudsiger, at HS-AFM er muligt at afsløre strømmen af irreversible konformationsændringer af HA2 forårsaget af lav pH, som efterligner de sande biologiske hændelser, der opstår, når HA kommer ind i et værtsendosom, i fremtidig undersøgelse. "
 Varme artikler
Varme artikler
-
 Nyt mikroskop sætter rekord for visualisering af overfladebefugtningsegenskaberMikroskopets dråbesonde på en superhydrofob gylden fuglevinge (Troides aeacus) sommerfuglevinge. Kredit:Matti Hokkanen / Aalto University Mikroskopet er 1000 gange mere præcist end nuværende tekni
Nyt mikroskop sætter rekord for visualisering af overfladebefugtningsegenskaberMikroskopets dråbesonde på en superhydrofob gylden fuglevinge (Troides aeacus) sommerfuglevinge. Kredit:Matti Hokkanen / Aalto University Mikroskopet er 1000 gange mere præcist end nuværende tekni -
 Nye forbindelser med anticarcinogene forbindelser syntetiseretInmaculada Fernández og Rocío Recio og Noureddine Khiar. Kredit:CSIC Stereokemi og asymmetrisk syntesegruppe ved Det Farmaceutiske Fakultet ved University of Sevilla, i samarbejde med Asymmetric S
Nye forbindelser med anticarcinogene forbindelser syntetiseretInmaculada Fernández og Rocío Recio og Noureddine Khiar. Kredit:CSIC Stereokemi og asymmetrisk syntesegruppe ved Det Farmaceutiske Fakultet ved University of Sevilla, i samarbejde med Asymmetric S -
 Bæredygtige sprøjtebetonblandingsdesign til tunneler med længere levetidAnvendelsen af sprøjtebeton er en af de vigtigste støtteforanstaltninger i tunnelbyggeriet. Kredit:ASSpC - TU Graz Levetiden for tunneler i dag er designet til at holde i mindst hundrede år -
Bæredygtige sprøjtebetonblandingsdesign til tunneler med længere levetidAnvendelsen af sprøjtebeton er en af de vigtigste støtteforanstaltninger i tunnelbyggeriet. Kredit:ASSpC - TU Graz Levetiden for tunneler i dag er designet til at holde i mindst hundrede år - -
 Manipulerede enzymer – forskere sætter milepæl i biokatalyseforskningKathrin Heckenbichler og Rolf Breinbauer og deres team formåede for første gang nogensinde at genoplære et enzym til at bygge ringformede molekylære strukturer i stedet for at udføre sin naturlige opg
Manipulerede enzymer – forskere sætter milepæl i biokatalyseforskningKathrin Heckenbichler og Rolf Breinbauer og deres team formåede for første gang nogensinde at genoplære et enzym til at bygge ringformede molekylære strukturer i stedet for at udføre sin naturlige opg
- Hvad er produkter af cellulær respiration?
- Ingen anden chance for at gøre et tillidsfuldt første indtryk, eller er der?
- Ubåde små nok til at levere medicin inde i menneskekroppen
- Første fælles Frankrig-Kina-satellit til at studere oceaner
- Sig farvel til prikkerne og stregerne for at forbedre optiske lagermedier
- Nanovaccine øger immuniteten hos patienter med metabolisk syndrom


