Mekanisme for hæmning af skorpiontoksin af K+ -kanalen belyst ved hjælp af højhastigheds-AFM
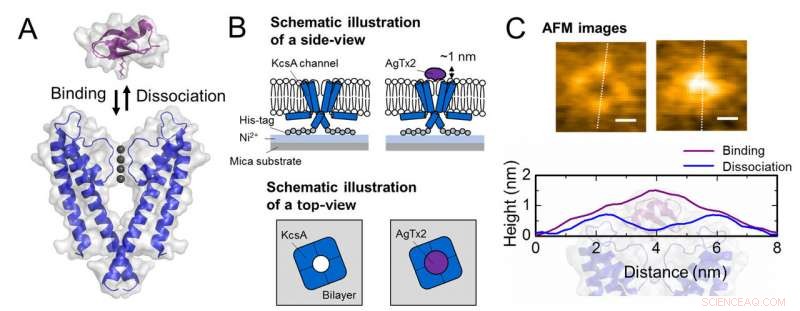
Ordning for forening og dissociation af kaliumkanal KcsA (Q58A/T61S/R64D) og AgTx2 og repræsentative AFM-billeder. A. Forening (binding) af KcsA og AgTx2. B. Skema, der viser en prøve til AFM-observation.
C. Repræsentative AFM -billeder og med dimensioner vist som hvide stiplede linjer. Bar, 2 nm. Kredit:Kanazawa University
Agitoxin-2 (AgTx2) fra skorpiongift er en potent blokering af K+-kanaler. Forskere har nu observeret bindingsdynamikken for AgTx2 til KcsA-kanalen ved hjælp af højhastigheds atomkraftmikroskopi. Enkeltmolekyle kinetiske analyser afslørede, at affiniteten af kanalen for AgTx2 steg under vedvarende binding og faldt under vedvarende dissociation. Forskerne foreslår en fire-tilstandsmodel med relevante hastighedskonstanter. En induceret-tilpasningsvej var dominerende og accelererede bindingen med 400 gange.
Cellemembraner indeholder ionkanaler, der regulerer permeationen af forskellige ioner mellem indersiden og ydersiden af cellen. Ionkanaler er proteiner, og som reaktion på forskellige stimuli, de lader specifikke ioner trænge igennem. På den måde regulerer cellen de elektriske signaler, der danner grundlag for musklernes og nervesystemets funktion. Da en funktionsfejl i ionkanaler forårsager en række lidelser såsom myokardieinfarkt og epilepsi, det er vigtigt at forstå virkningsmekanismen for molekyler, der hæmmer ionkanalfunktioner.
Skorpiongift har vist sig at indeholde mere end 200 forbindelser, der binder til K+-kanaler. Blandt dem, AgTx2 er et peptid bestående af 38 aminosyrerester. Tidligere undersøgelser viste, at ved binding til K+ -kanalen uden for cellemembranen, AgTx2 blokerer K+-kanalporen og hæmmer K+-permeation. Imidlertid, den detaljerede molekylære mekanisme forblev ukendt, f.eks. om bindingsdynamikken kunne forklares ved en to-staters model for association og dissociation.
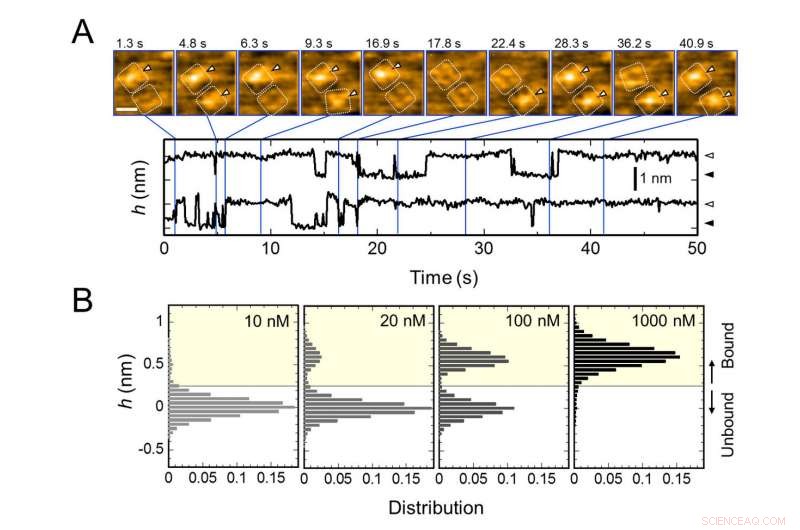
Gentagen binding af AgTx2 til kaliumkanal KcsA og AgTx2 - koncentrationsafhængighed af bindingssandsynlighed. A. Time-lapse-billeder af AgTx2-binding til og dissociation fra KcsA-kanalerne og tidsforløb af den gennemsnitlige højde (h) (nm) omkring midten af den ekstracellulære overflade. Skalalinje i HS-AFM-billedet, 5 nm. B. Højde histogrammer af h afhængigt af AgTx2 -koncentrationen i opløsningen. Kredit:Kanazawa University
Forskergruppen, herunder videnskabsmænd fra Kanazawa University, visualiserede associationen og dissociationen af AgTx2 med K+-kanalen KcsA ved hjælp af højhastigheds atomkraftmikroskopi (HS-AFM) og udførte en detaljeret analyse af dynamikken (figur 1). KcsA er en tetramer, dens underenheder danner en ringlignende struktur. Ved AgTx2 -binding til tetrameroverfladen, den centrale del af kanalen, dvs. passagen for K+, syntes hævede på grund af AgTx2-binding. Binding og dissociation af AgTx2 til K+ -kanalen kunne finde sted gentagne gange, og højden omkring kanalcentret ændrede sig tilsvarende (figur 2).
Når AgTx2 -koncentrationen i opløsningen var høj, bindingssandsynligheden var også høj. Tidsforløb for binding og dissociation afslørede, at ved binding af AgTx2 til KcsA, konformationen af KcsA ændret, hvilket gjorde AgTx2 lettere at binde, og at selv ved dissociation af AgTx2, et andet AgTx2-molekyle kunne binde til KcsA meget hurtigt; dette betegnes som en induceret pasform-mekanisme. På den anden side, det blev observeret, at når der er gået tilstrækkelig tid efter AgTx2-dissociation, konformationen af KcsA ændret tilbage til den oprindelige, hvortil AgTx2 bandt mindre let.
Disse resultater indikerer, at bindingsdynamikken ikke kan forklares med en simpel totilstandsmodel, dvs. binding og dissociation. Det så ud til, at både KcsA's associations- og dissociationstilstande kunne skelnes som mindst to delstater; en fire -statssammenslutningsmodel blev derfor overvejet (figur 3). Når reaktionshastighederne blev beregnet for en fire-tilstandsmodel, afspejlede de opnåede hastigheder de opnåede eksperimentelt. En simulering af bindingsdynamikken med denne firestatsmodel og de tilhørende reaktionshastigheder, viste, at AgTx2-binding primært var via den inducerede tilpasningsvej. Yderligere, det blev fundet, at den inducerede tilpasning accelererede AgTx2-binding 400 gange. Dermed, mekanismen for AgTx2 til effektivt at hæmme funktionen af KcsA er blevet belyst (figur 3).
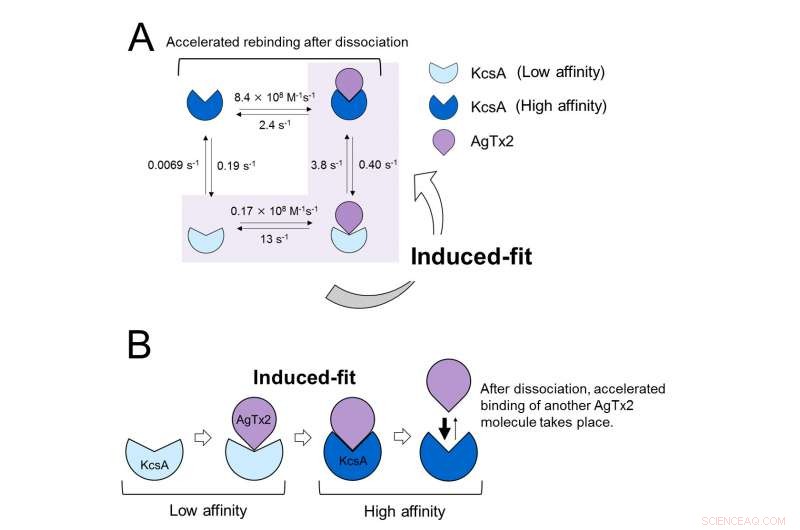
Bindende dynamik model af AgTx2 og kaliumkanal KcsA. A. Vurder konstanter for reaktionstrin. B. Accelereret binding af AgTx2 til kaliumkanal KcsA gennem induceret tilpasningsmekanisme. Kredit:Kanazawa University
HS-AFM-observationsteknikken og -metoden, der anvendes til analyse af binding af K+-kanalen og peptidinhibitoren, kan anvendes på en lang række biologiske molekyler. De kan anvendes på analyser af en ligand, der binder til dens receptor, samt forening af DNA og et DNA-bindende protein. Denne undersøgelse forventes at fremskynde belysningen af bindingsdynamikken for forskellige biologiske molekyler.
Undersøgelsen er offentliggjort i Videnskabens fremskridt .
 Varme artikler
Varme artikler
-
 Forskere opnår nye resultater om korrosionsadfærd af legeringsmaterialer under ekstreme miljøerFig. 1. Skematisk diagram af højtemperatur- og højtryksvanddynamisk korrosionsanordning. Kredit:LIU Chao Materialers serviceadfærd under ekstreme miljøer er en af flaskehalsene, der begrænser ud
Forskere opnår nye resultater om korrosionsadfærd af legeringsmaterialer under ekstreme miljøerFig. 1. Skematisk diagram af højtemperatur- og højtryksvanddynamisk korrosionsanordning. Kredit:LIU Chao Materialers serviceadfærd under ekstreme miljøer er en af flaskehalsene, der begrænser ud -
 Neutronmicellemålinger giver indsigt i forbedret lægemiddelleveringTyler Cooksey, en kandidatforsker ved University of Houston, bruger ORNLs Bio-SANS-instrument ved High Flux Isotope Reactor til at forstå, hvordan miceller kan forbedres for at skabe mere effektive læ
Neutronmicellemålinger giver indsigt i forbedret lægemiddelleveringTyler Cooksey, en kandidatforsker ved University of Houston, bruger ORNLs Bio-SANS-instrument ved High Flux Isotope Reactor til at forstå, hvordan miceller kan forbedres for at skabe mere effektive læ -
 Hvad er funktionerne ved kulhydratanhydrase?Kulhydridanhydrase er et afgørende enzym, der fungerer i dyreceller, planteceller og i miljøet for at stabilisere kuldioxidkoncentrationer. Uden dette enzym ville omdannelsen fra kuldioxid til bicarbo
Hvad er funktionerne ved kulhydratanhydrase?Kulhydridanhydrase er et afgørende enzym, der fungerer i dyreceller, planteceller og i miljøet for at stabilisere kuldioxidkoncentrationer. Uden dette enzym ville omdannelsen fra kuldioxid til bicarbo -
 Brug af stamme til at kontrollere oxynitrid -egenskaberForskere fandt en måde at oprette og kontrollere retningen og periodiciteten af ilt-ledige lag i oxynitridkrystaller ved en temperatur så lav som 600 ° C. Kredit:Mindy Takamiya/Kyoto University iCeM
Brug af stamme til at kontrollere oxynitrid -egenskaberForskere fandt en måde at oprette og kontrollere retningen og periodiciteten af ilt-ledige lag i oxynitridkrystaller ved en temperatur så lav som 600 ° C. Kredit:Mindy Takamiya/Kyoto University iCeM
- Opsuger vandet og sveden - et nyt super tørremiddel
- Hvordan man kan forklare magneter til Kindergarteners
- Ultrahurtig gas strømmer gennem de mindste huller i 2D-membraner
- Sådan læses metriske bolte
- Familien betyder noget:Hvorfor folk kan have politiske holdninger, der er til ulempe for deres eget …
- Skilsmisses effekt på børns uddannelsesmæssige resultater er ikke en konstant


