Plast, brændstoffer og kemiske råstoffer fra CO2? De arbejder på det
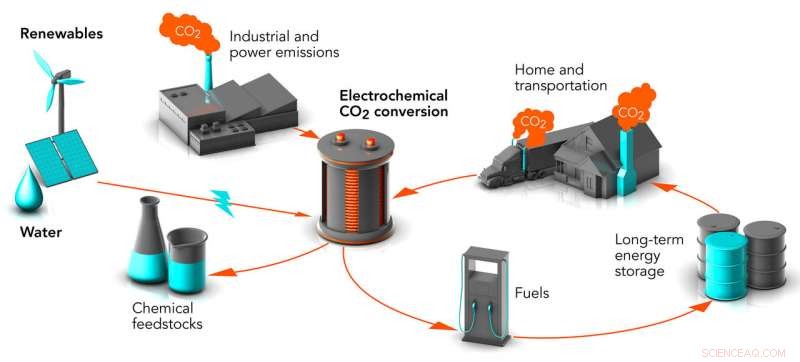
Forskere ved Stanford og SLAC arbejder på måder at omdanne kuldioxidaffald (CO2) til kemiske råvarer og brændstoffer, gør en potent drivhusgas til værdifulde produkter. Processen kaldes elektrokemisk omdannelse. Når den drives af vedvarende energikilder, det kan reducere niveauer af kuldioxid i luften og lagre energi fra disse periodiske kilder i en form, der kan bruges når som helst. Kredit:Greg Stewart/SLAC National Accelerator Laboratory
En måde at reducere niveauet af kuldioxid i atmosfæren, som nu er på sit højeste punkt i 800, 000 år, ville være at fange den potente drivhusgas fra fabrikker og kraftværks røgstokke og bruge vedvarende energi til at gøre det til ting, vi har brug for, siger Thomas Jaramillo.
Som direktør for SUNCAT Center for Interface Science and Catalysis, et fælles institut for Stanford University og Department of Energy's SLAC National Accelerator Laboratory, han er i stand til at hjælpe med at få det til at ske.
Et stort fokus for SUNCAT -forskning er at finde måder at transformere CO 2 til kemikalier, brændstoffer, og andre produkter, fra methanol til plast, vaskemidler og syntetisk naturgas. Produktionen af disse kemikalier og materialer fra fossile ingredienser tegner sig nu for 10% af de globale kulstofemissioner; produktion af benzin, diesel, og jetbrændstof står for meget, meget mere.
”Vi har allerede udledt for meget CO 2 , og vi er på rette vej til at fortsætte med at udsende det i årevis, da 80% af den energi, der forbruges på verdensplan i dag, stammer fra fossile brændstoffer, "siger Stephanie Nitopi, hvis SUNCAT -forskning er grundlaget for hendes nyerhvervede Stanford Ph.D.
"Du kunne fange CO 2 fra røgstakke og opbevar det under jorden, "siger hun." Det er en teknologi, der aktuelt spilles. Et alternativ er at bruge det som råstof til fremstilling af brændstoffer, plast, og specialkemikalier, som forskyder det økonomiske paradigme. Affald CO 2 emissioner bliver nu noget, du kan genbruge til værdifulde produkter, giver et nyt incitament til at reducere mængden af CO 2 frigivet i atmosfæren. Det er en win-win. "
Vi spurgte Nitopi, Jaramillo, SUNCAT -personaleforsker Christopher Hahn og postdoktorforsker Lei Wang for at fortælle os, hvad de arbejder med, og hvorfor det er vigtigt.
Sp. Først det grundlæggende:Hvordan konverterer man CO 2 til disse andre produkter?
Tom:Det er i det væsentlige en form for kunstig fotosyntese, derfor finansierer DOE's Joint Center for Artificial Photosynthesis vores arbejde. Planter bruger solenergi til at omdanne CO 2 fra luften til kulstof i deres væv. Tilsvarende vi ønsker at udvikle teknologier, der bruger vedvarende energi, som sol eller vind, at konvertere CO 2 fra industrielle emissioner til kulstofbaserede produkter.
Chris:En måde at gøre dette på kaldes elektrokemisk CO 2 reduktion, hvor du bobler CO 2 gas op gennem vand, og det reagerer med vandet på overfladen af en kobberbaseret elektrode. Kobberet fungerer som en katalysator, bringe de kemiske ingredienser sammen på en måde, der tilskynder dem til at reagere. Sagt meget enkelt, den indledende reaktion fjerner et oxygenatom fra CO 2 for at danne kulilte, eller CO, som er et vigtigt industrikemikalie i sig selv. Derefter forvandler andre elektrokemiske reaktioner CO til vigtige molekyler såsom alkoholer, brændstoffer og andre ting.
I dag kræver denne proces en kobberbaseret katalysator. Det er den eneste, der kender jobbet. Men disse reaktioner kan producere mange produkter, og at skille den, du ønsker, er dyrt, så vi er nødt til at identificere nye katalysatorer, der er i stand til at styre reaktionen mod kun at lave det ønskede produkt.
Hvordan det?
Lei:Når det kommer til at forbedre en katalysators ydeevne, en af de vigtigste ting, vi ser på, er, hvordan vi gør dem mere selektive, så de genererer kun et produkt og intet andet. Omkring 90 procent af brændstof og kemisk fremstilling afhænger af katalysatorer, og at slippe af med uønskede biprodukter er en stor del af omkostningerne.
Vi ser også på, hvordan man kan gøre katalysatorer mere effektive ved at øge deres overfladeareal, så der er mange flere steder i en given mængde materiale, hvor reaktioner kan forekomme samtidigt. Dette øger produktionshastigheden.
For nylig opdagede vi noget overraskende:Da vi øgede overfladearealet på en kobberbaseret katalysator ved at danne den til en flakket "nanoflower" -form, det gjorde reaktionen både mere effektiv og mere selektiv. Faktisk, det producerede stort set ingen biprodukt hydrogengas, som vi kunne måle. Så dette kunne tilbyde en måde at justere reaktioner på for at gøre dem mere selektive og omkostningskonkurrencedygtige.
Stephanie:This was so surprising that we decided to revisit all the research we could find on catalyzing electrochemical CO 2 conversion with copper, and the many ways people have tried to understand and fine-tune the process, using both theory and experiments, going back four decades. There's been an explosion of research on this—about 60 papers had been published as of 2006, versus more than 430 out there today—and analyzing all the studies with our collaborators at the Technical University of Denmark took two years.
We were trying to figure out what makes copper special, why it's the only catalyst that can make some of these interesting products, and how we can make it even more efficient and selective—what techniques have actually pushed the needle forward? We also offered our perspectives on promising research directions.
One of our conclusions confirms the results of the earlier study:The copper catalyst's surface area can be used to improve both the selectivity and overall efficiency of reactions. So this is well worth considering as a chemical production strategy.
Does this approach have other benefits?
Tom:Absolutely. If we use clean, renewable energy, like wind or solar, to power the controlled conversion of waste CO 2 to a wide range of other products, this could actually draw down levels of CO 2 in the atmosphere, which we will need to do to stave off the worst effects of global climate change.
Chris:And when we use renewable energy to convert CO 2 to fuels, we're storing the variable energy from those renewables in a form that can be used any time. Ud over, with the right catalyst, these reactions could take place at close to room temperature, instead of the high temperatures and pressures often needed today, making them much more energy efficient.
How close are we to making it happen?
Tom:Chris and I explored this question in a recent Perspective article in Videnskab , written with researchers from the University of Toronto and TOTAL American Services, which is an oil and gas exploration and production services firm.
We concluded that renewable energy prices would have to fall below 4 cents per kilowatt hour, and systems would need to convert incoming electricity to chemical products with at least 60% efficiency, to make the approach economically competitive with today's methods.
Chris:This switch couldn't happen all at once; the chemical industry is too big and complex for that. So one approach would be to start with making high-value, high-volume products like ethylene, which is used to make alcohols, polyester, antifreeze, plastics and synthetic rubber. It's a $230 billion global market today. Switching from fossil fuels to CO 2 as a starting ingredient for ethylene in a process powered by renewables could potentially save the equivalent of about 860 million metric tons of CO 2 emissions per year.
The same step-by-step approach applies to sources of CO 2 . Industry could initially use relatively pure CO 2 emissions from cement plants, breweries or distilleries, for eksempel, and this would have the side benefit of decentralizing manufacturing. Every country could provide for itself, develop the technology it needs, and give its people a better quality of life.
Tom:Once you enter certain markets and start scaling up the technology, you can attack other products that are tougher to make competitively today. What this paper concludes is that these new processes have a chance to change the world.
 Varme artikler
Varme artikler
-
 Brug af platin-molybdæncarbid til katalytisk at frigive brint til at drive en brændselscelleReaktionsvej for brintproduktion fra methanol og vand. Kredit:(c) Natur (2017). DOI:10.1038/nature21672 (Phys.org) - Et team af forskere fra flere institutioner i Kina og USA har udviklet en måd
Brug af platin-molybdæncarbid til katalytisk at frigive brint til at drive en brændselscelleReaktionsvej for brintproduktion fra methanol og vand. Kredit:(c) Natur (2017). DOI:10.1038/nature21672 (Phys.org) - Et team af forskere fra flere institutioner i Kina og USA har udviklet en måd -
 2-D-materialer kan gøre det muligt for elektriske køretøjer at komme 500 miles på en enkelt opla…2D-katalysatorer driver et elektrisk køretøj. Kredit:Amin Salehi-Khojin Lithium-luft-batterier er klar til at blive den næste revolutionerende erstatning for aktuelt brugte lithium-ion-batterier,
2-D-materialer kan gøre det muligt for elektriske køretøjer at komme 500 miles på en enkelt opla…2D-katalysatorer driver et elektrisk køretøj. Kredit:Amin Salehi-Khojin Lithium-luft-batterier er klar til at blive den næste revolutionerende erstatning for aktuelt brugte lithium-ion-batterier, -
 Hvordan elektroderne i lithium-luftbatterier bliver passiveredeEn elektrokemisk celle til studier af processers mekanismer, foregår i lithium-luft-batterier. Kredit:Alexei Khokhlov Lithium-luft-batterier producerer strøm fra luft, og kaldes ofte lithium-oxyge
Hvordan elektroderne i lithium-luftbatterier bliver passiveredeEn elektrokemisk celle til studier af processers mekanismer, foregår i lithium-luft-batterier. Kredit:Alexei Khokhlov Lithium-luft-batterier producerer strøm fra luft, og kaldes ofte lithium-oxyge -
 Katalyserende kuldioxid:Systemet kan omdanne CO2 til CO til brug i industrienBall-and-stick model af kuldioxid. Kredit:Wikipedia På en given dag, mere end 2 millioner pund kuldioxid pumpes ud i atmosfæren fra fabrikker, emissioner fra biler og lastbiler og afbrænding af ku
Katalyserende kuldioxid:Systemet kan omdanne CO2 til CO til brug i industrienBall-and-stick model af kuldioxid. Kredit:Wikipedia På en given dag, mere end 2 millioner pund kuldioxid pumpes ud i atmosfæren fra fabrikker, emissioner fra biler og lastbiler og afbrænding af ku
- Rumbobleeksperiment kan føre til mere effektive tidlige kræftscreeninger
- Forskere fanger let klemme og strække næste generations datalagringsmateriale
- Største rumstationskare i årti efter SpaceX-ankomst
- Big data, maskinlæring kaster lys over de asiatiske genplantningssucceser
- Denne supernova-pizza i et laboratorium efterligner de kosmiske eksplosioner pragtfulde eftervirknin…
- Hvor grønt er miljøvenligt fyrværkeri?


