Hook-on medicin:Ny leveringsstrategi for K-Ras disruption

Dr. Ohkanda holder sammensætningen strategisk designet til at hægte sig ind i hullet i enzymet. Kredit:Junko Ohkanda Ph.D., Professor i Akademisk Forsamling, Landbrugsinstituttet, Shinshu Universitet
"Strategien var at designe stoffet til at kunne hægte sig ind i hullet i FTase og GGTase I, ellers er overfladen af proteinerne for stor og glat, " Dr. Junko Ohkanda fra Shinshu University forklarer sin strategi bag hendes papir valgt af Kemi - Et europæisk tidsskrift som et "Hot Paper".
Farmaceutiske virksomheder rundt om i verden har forsøgt at lave et effektivt lægemiddel til at målrette K-Ras-proteiner i de sidste 20 til 30 år. Når K-Ras-proteiner muterer, de får multiplikationskontakten til at forblive konstant tændt, bliver en aggressiv og ubehandlelig form for kræft. I 90 til 100 % af de vanskelige lunge- og bugspytkirtelkræft, K-Ras siges at spille en rolle. 30% af alle kræftformer siges at have en form for Ras-mutation.
Forskere har haft problemer med at designe et lægemiddel til at infiltrere K-Ras på grund af mangel på interaktive lommer. En ny strategi blev udtænkt for at angribe FTase, et vigtigt enzym i lipidmodifikationen af K-Ras. Uden FTase, de muterede K-Ras ville ikke være i stand til at formere sig ukontrolleret. Forskere har udviklet et stort antal FTase-hæmmere, men fandt det svært at inaktivere K-Ras modifikation.
Selv når FTase var hæmmet, K-Ras-modifikationer blev ikke stoppet, fordi GGTase I også reagerede med K-Ras, på trods af dets anderledes reaktive hulrum. Man forstod ikke hvorfor, indtil dets mekanisme blev belyst, at FTase og GGTase I begge er lavet af to proteindele, hvoraf den ene er den samme, med nøjagtig samme DNA.
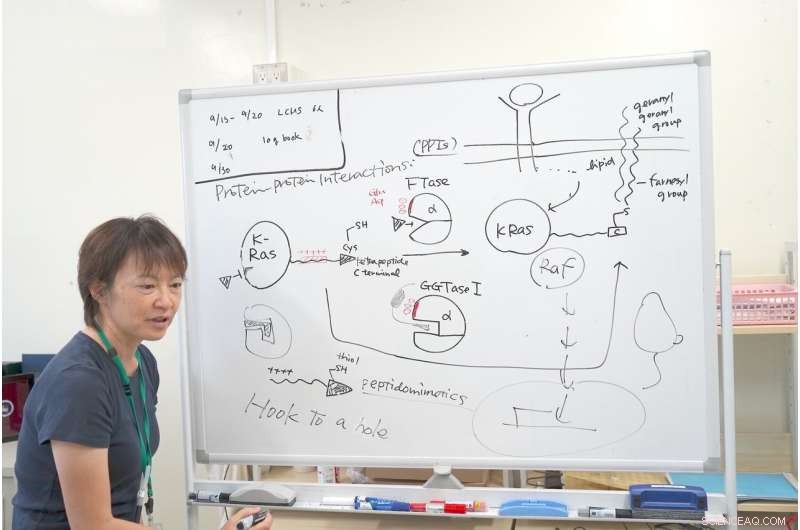
Dr. Ohkanda forklarer mekanismen i hendes forskning med K-Ras. Kredit:Junko Ohkanda Ph.D., Professor i Akademisk Forsamling, Landbrugsinstituttet, Shinshu Universitet
I nærheden af det aktiverede hulrum FTase og GGTase har jeg den samme klynge af sure aminosyrer, som glutaminsyre og asparaginsyre, bærer en negativ ladning. Når man nøje observerer K-Ras C-terminalen, den havde en interaktiv positiv ladning. Andre Ras-proteiner har ikke dette positivt ladede område. Kun K-Ras har denne klynge af positive ladninger. Dette er grunden til, at selvom FTase blev hæmmet, K-Ra'erne reagerede stadig med GGTase I, selvom dens hulrum var anderledes.
Det var her, Dr. Ohkanda havde sit øjeblik af inspiration. I teorien, lommen på enzymet og cystin-nøglen hæfter og går sammen. Men i dette tilfælde overfladerne af proteinerne, med plus og minus interagerer også. Selv hvis FTase er hæmmet, interagerede K-Ras fejlagtigt med GGTase I. Dr. Ohkanda og hendes kolleger troede, at de kunne have to funktioner med en forbindelse.
Strategien var at designe et molekyle til at efterligne den del af K-Ras, der virker på den aktive lomme og også den sure overflade. Det siger sig selv, at stoffets funktion skal ske inde i cellen. Store molekyler, der er nyttige i protein-protein-interaktioner, er ofte for store til at gå ind i cellen. Dette er et problem, der forvirrer mange lægemiddeludviklere:leveringsmetoder.
Dr. Ohkanda tænkte, om hun rationelt kunne designe thiolen på enden af K-Ras til at hænge på den aktive lomme af FTase og GGTase I, den udvidede interaktive positive ladningsdel kunne interagere og trænge ind i cellemembranen. Hvis cysteindelen kunne hænge fast i hulrummet, den forbundne interaktive positive kæde kan være lille og afgives strategisk til den sure overflade af enzymerne.. Det var vanskeligt at minimere størrelsen af forbindelsen, samtidig med at den øgede dens stabilitet og bevarede dens evne til kemiske reaktioner. Ved at bruge en peptidomimetik af samme længde og samme nøgle, de var i stand til at trænge ind i cellen in vitro, forstyrre den løbske K-Ras multiplikation.
Flere undersøgelser er nødvendige for at øge aktiviteten af forbindelsen, test in vivo og for at evaluere dets toksicitet længe før stoffet kan anvendes som behandling for cancer. Dr. Ohkanda fortsætter med at arbejde sammen med et internationalt team af eksperter for at belyse virkningsmekanismen og deres interaktioner for rationelt at designe effektive lægemidler til at stoppe formering af sådanne celler.
 Varme artikler
Varme artikler
-
 Hvad sker der, når du lægger guld i Muriatic Acid?Guld er sandsynligvis den mest værdsatte af de såkaldte ædelmetaller, der har været brugt i kunst og smykker i århundreder og for nylig har fundet anvendelser inden for medicin, mønter og andre ste
Hvad sker der, når du lægger guld i Muriatic Acid?Guld er sandsynligvis den mest værdsatte af de såkaldte ædelmetaller, der har været brugt i kunst og smykker i århundreder og for nylig har fundet anvendelser inden for medicin, mønter og andre ste -
 Forskere udvikler isskabelonet fyldstofskelet med forbedret termisk ledningsevneFremstilling og karakterisering af 3-D BN-SiC skelet. Kredit:Dr. YAO Yimin Et forskerhold ledet af Dr. Sun Rong og Dr. Zeng Xiaoliang fra Shenzhen Institutes of Advanced Technology (SIAT) under de
Forskere udvikler isskabelonet fyldstofskelet med forbedret termisk ledningsevneFremstilling og karakterisering af 3-D BN-SiC skelet. Kredit:Dr. YAO Yimin Et forskerhold ledet af Dr. Sun Rong og Dr. Zeng Xiaoliang fra Shenzhen Institutes of Advanced Technology (SIAT) under de -
 Ny proces indsnævrer kløften mellem naturlige og syntetiske materialerKredit:EPFL Naturmaterialer som hud, brusk og sener er hårde nok til at understøtte vores kropsvægt og bevægelser, alligevel fleksible nok til at de ikke revner let. Selvom vi tager disse ejendomm
Ny proces indsnævrer kløften mellem naturlige og syntetiske materialerKredit:EPFL Naturmaterialer som hud, brusk og sener er hårde nok til at understøtte vores kropsvægt og bevægelser, alligevel fleksible nok til at de ikke revner let. Selvom vi tager disse ejendomm -
 Undersøgelse tilbyder ny indsigt i solopsamlingsteknologierCover af ACS Applied Energy Materials, der viser en katalysatormodificeret solcelle, der producerer brintbrændstof under forskellige lysforhold. Kredit:Grafisk af Jason Drees Hver time, solen mætt
Undersøgelse tilbyder ny indsigt i solopsamlingsteknologierCover af ACS Applied Energy Materials, der viser en katalysatormodificeret solcelle, der producerer brintbrændstof under forskellige lysforhold. Kredit:Grafisk af Jason Drees Hver time, solen mætt
- Bikulturalisme starter i klasseværelset
- Video:Med klimaændringer, er vi som hvalen i The Hitchhikers Guide to the Galaxy?
- Private equity-koncernen Advent tager kontrol over Walmart Brasilien
- AI kunne hjælpe med at håndtere naturkatastrofer – men kun i et vist omfang
- Forskere foreslår nyt dikroisk laserspejldesign med blandingslag og sandwich-lignende strukturgræn…
- USA står foran et offshore vindkraftboom. Hvorfor udnytter energiselskaber ikke det?


