Forskere fremmer forståelsen af vitale enzymer

Douglas Rees (til venstre) og Garnet Chan (til højre). Kredit:Caltech
nitrogenaser, de enzymer, der er ansvarlige for at omdanne atmosfærisk nitrogen til de nitrogenbaserede forbindelser, der bruges af levende ting, har været et stort fokus for kemiforskning i årtier på grund af den afgørende rolle, som nitrogengødning spiller i at brødføde planetens voksende befolkning.
To Caltech-forskere har stået i spidsen for studier af disse vigtige enzymers molekylære struktur:Douglas Rees og Garnet Chan.
Rees, Caltechs Roscoe Gilkey Dickinson professor i kemi, efterforsker ved Howard Hughes Medical Institute, og dekan for kandidatstudier, er en af pionererne inden for denne forskning. I 1992, Rees udgav det første papir, der beskrev strukturen af et nitrogenaseenzym. Siden da, hans laboratorium har fortsat med at undersøge strukturen og adfærden af disse molekyler. Som en anerkendelse af hans arbejde, Det Kongelige Svenske Videnskabsakademi udnævnte i september Rees til en af vinderne af dette års Gregori Aminoff-pris. Prisen uddeles årligt til forskere for deres præstationer inden for krystallografi.
"Mekanismen for biologisk nitrogenfiksering har fascineret kemikere i over et århundrede, ", siger Rees. "Min gruppe har nærmet sig dette spørgsmål ved at bestemme røntgenkrystalstrukturerne af de nitrogenaseproteiner, der katalyserer omdannelsen af atmosfærisk dinitrogen til ammoniak under fysiologiske forhold. Gennem indsatsen fra en bemærkelsesværdig gruppe af kandidatstuderende og postdoc-stipendiater, i et fortsat samarbejde med min tidligere postdoc-vejleder, James Howard, vi har været i stand til at definere nitrogenases molekylære arkitektur i udsøgte detaljer, med særlig fokus på de usædvanlige metalklynger, der giver det aktive sted for denne reaktion."
Chan, Caltechs Bren-professor i kemi, har også forsket i strukturen af nitrogenaser, ved hjælp af beregningsmetoder, der tilbyder supplerende information til studierne af Rees. Chans speciale er kvantekemi, et felt, der forsøger at forklare kemiske egenskaber gennem principper for kvantemekanik.
Denne måned, Chan og hans kolleger udgav et nyt papir om nitrogenase i Naturkemi . I det blad, de skitserer den elektroniske struktur - arrangementet af elektroner - af de såkaldte P-klynger, der findes i nitrogenaseenzymer, som bestemt gennem computersimuleringer. P-klynger er områder i enzymet, der består af flere jern- og svovlatomer bundet sammen. De er ansvarlige for en del af den kemiske proces, der omdanner nitrogengas til nitrogenforbindelser som ammoniak, eller nitrogenfiksering.
At bestemme, hvordan elektroner er arrangeret i disse P-klynger, ville hjælpe forskere med bedre at forstå den mekanisme, der ligger til grund for nitrogenfiksering, men disse ordninger har vist sig vanskelige at studere. Chans arbejde bygger på nye beregningsteknikker udviklet i hans laboratorium baseret på ideerne om kvanteinformationsteori.
"Uden Dougs banebrydende undersøgelser ville vi ikke vide, hvordan atomerne er arrangeret i P-klyngen, " siger Chan. "Men med viden om disse positioner, vi kan nu bruge teoretisk kvantemekanik til at visualisere, hvor elektronerne er, tilføjer et nyt kapitel til denne igangværende historie."
Chans papir, med titlen, "Elektronisk landskab af P-klyngen af nitrogenase som afsløret gennem kvante mange-elektron bølgefunktion simuleringer, " vises i 30. september-udgaven af Naturkemi .
 Varme artikler
Varme artikler
-
 Ny sensor måler calciumkoncentrationer dybt inde i vævetCalciumbølger - en ny sensor konverterer lys til lyd for at visualisere calciumflux i kroppen. Kredit:B. van Rossum, G. Westmeyer / Münchens tekniske universitet Nøgleprocesser i kroppen styres af
Ny sensor måler calciumkoncentrationer dybt inde i vævetCalciumbølger - en ny sensor konverterer lys til lyd for at visualisere calciumflux i kroppen. Kredit:B. van Rossum, G. Westmeyer / Münchens tekniske universitet Nøgleprocesser i kroppen styres af -
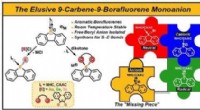 Stabilisering af borafluorenanionen med carbenerKredit:Wiley-VCH, Angewandte Chemie International Edition (2021). DOI:10.1002/anie.202103628 Inkorporeringen af bor i polycykliske aromatiske kulbrintesystemer fører til interessante kromofore
Stabilisering af borafluorenanionen med carbenerKredit:Wiley-VCH, Angewandte Chemie International Edition (2021). DOI:10.1002/anie.202103628 Inkorporeringen af bor i polycykliske aromatiske kulbrintesystemer fører til interessante kromofore -
 Forskeren rapporterer, hvordan seglceller dannes, kan være nøglen til at stoppe demUniversity of Houston lektor i kemi Vassiliy Lubchenko udforsker seglcellesygdom, som påvirker omkring 100, 000 amerikanere, mest afroamerikanere og latinamerikanere. Kredit:University of Houston
Forskeren rapporterer, hvordan seglceller dannes, kan være nøglen til at stoppe demUniversity of Houston lektor i kemi Vassiliy Lubchenko udforsker seglcellesygdom, som påvirker omkring 100, 000 amerikanere, mest afroamerikanere og latinamerikanere. Kredit:University of Houston -
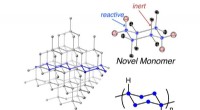 Ny polymer inspireret af krystallinsk silicium til at bygge bedre computere og solcellerAt finde nye måder at lave bedre materialer til elektroniske kredsløb på er en måde at lave en bedre enhed. En ny polymer, kaldet poly (cyclosilane) (nederst til højre), er i det væsentlige en ultra-l
Ny polymer inspireret af krystallinsk silicium til at bygge bedre computere og solcellerAt finde nye måder at lave bedre materialer til elektroniske kredsløb på er en måde at lave en bedre enhed. En ny polymer, kaldet poly (cyclosilane) (nederst til højre), er i det væsentlige en ultra-l
- Imec rapporterer for første gang direkte vækst af 2-D materialer på 300 mm skiver
- Fem indsigter, der kan flytte turismen tættere på bæredygtighed
- Hubble viser en bemærkelsesværdig galaktisk hybrid
- Portugisiske naturbrande omkranser Algarve ferieby
- Forskere producerer 50x mere stabilt adsorbent
- Ny topologisk isolator omdirigerer fotonisk trafik i farten


