Undersøgelse afslører den indviklede måde, hvorpå to proteiner interagerer for at fremme cellebevægelse, metastase
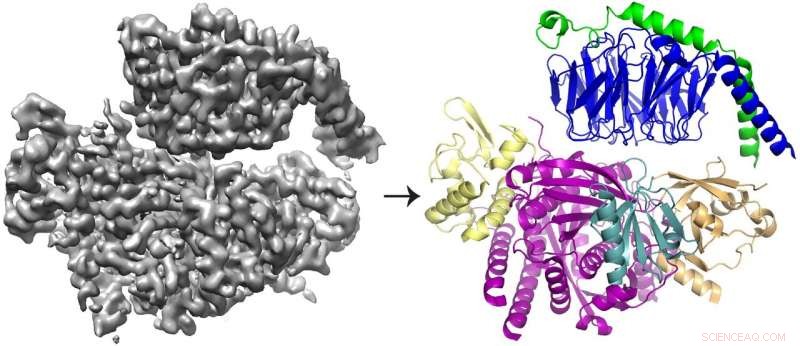
Cryo-EM 3D-rekonstruktionen (til venstre) af proteinet P-Rex1 bundet til Gβγ og proteinmodellen (til højre), der viser, at Gβγ (øverst; blå og grøn) binder til en kompakt, multi-domæne overflade på P-Rex1 (nederst; gul, magenta, blågrøn og guld). Kredit:Jennifer Cash, UM LifeSciences Institute.
Når celler i vores kroppe skal bevæge sig – for at angribe en infektion eller hele et sår, for eksempel - cellulære proteiner sender og modtager en kaskade af signaler, der dirigerer cellerne til det rigtige sted på det rigtige tidspunkt. Det er en proces, kræftceller kan kapere for at sprede sig til nye væv og organer.
Nu, et team af forskere ledet af University of Michigan Life Sciences Institute har belyst en vigtig drivkraft for denne proces. Fundene, planlagt til at udgive 16. oktober i Videnskabens fremskridt , tilbyde vigtig indsigt i cellemigration, ikke kun under normale helbredsforhold, men også i brystet, prostata og andre former for kræft.
Forskerne undersøgte specifikt et protein kaldet P-Rex1 (phosphatidylinositol 3, 4, 5-trifosfatafhængig Racveksler 1), som aktiveres, når det binder et andet protein, Gbg. På trods af opdagelsen af P-Rex1 for mere end 15 år siden, præcis hvordan de to proteiner interagerer, og hvordan denne interaktion fører til cellebevægelse, er forblevet dårligt forstået.
Ved at bruge en kombination af strukturel biologi og biokemi teknikker, forskerne har afsløret strukturen af P-Rex1 bundet til Gbg, giver et øjebliksbillede af, hvordan denne indviklede aktiveringsproces udfolder sig.
"At kende strukturen af dette proteinkompleks giver mekanistiske detaljer, der giver os mulighed for at forstå, hvordan det reguleres, " sagde Jennifer Cash, LSI-forsker og hovedforfatter af undersøgelsen. "Og når vi forstår, hvordan det er reguleret, vi kan begynde at tænke på, hvordan vi kan ændre den regulering og hæmme P-Rex1-signalering i kræftformer."
Holdet fandt ud af, at Gbg binder til en omfattende overflade på P-Rex1 bestående af flere forskellige proteindomæner. Tidligere undersøgelser tilbød modstridende argumenter om, hvilket domæne (eller domæner), der bandt Gbg. Men denne seneste undersøgelse var i stand til at løse konflikten ved at tage et større billede af proteinet, ved hjælp af nyere teknologier.
"Vi ønskede at se på enzymet som en helhed - og for at gøre det, vi havde virkelig brug for at flytte ind i cryo-EM, " sagde John Tesmer, professor i biologiske videnskaber ved Purdue University og en af undersøgelsens seniorforfattere.
Cryo-EM, eller kryo-elektronmikroskopi, gør det muligt for forskere at studere proteiner, der ikke kan visualiseres ved hjælp af andre strukturbiologiske teknikker - såsom det komplekse, sammenvævet struktur af P-Rex1. Processen går ud på at fryse proteiner i et tyndt lag vand og derefter bruge elektroner til at fange billeder af deres form. Hundredtusindvis af billeder beregnes derefter i gennemsnit for at skabe en 3D-struktur.
Udover at præcisere, hvordan Gbg binder sig til og aktiverer P-Rex1, disse nye resultater står som en vigtig prøvesten i udviklingen af cryo-EM, sagde Michael Cianfrocco, LSI adjunkt og seniorforfatter af undersøgelsen.
De fleste strukturer bestemt med cryo-EM er større, symmetriske molekyler. Resultaterne for P-Rex1, i modsætning, repræsenterer en struktur i høj opløsning af det mindste asymmetriske protein opnået gennem cryo-EM til dato. Desuden, et stort domæne i P-Rex1 har en struktur eller fold, der ikke tidligere var blevet identificeret i noget andet pattedyrsprotein, kræver, at teamet bygger det stykke for stykke - en vanskelig opgave med cryo-EM-data.
"Cryo-EM er stadig et relativt nyt felt, og folk er virkelig interesserede i at vide, hvor langt dets grænser kan skubbes, "sagde Cianfrocco, som også er adjunkt i biologisk kemi på U-M Medical School.
Science Advances-artiklerne har titlen "Kryo-elektronmikroskopistruktur og analyse af P-Rex1-Gbg-signalstilladset."
 Varme artikler
Varme artikler
-
 Brug af elektricitet til at nedbryde forurenende stoffer efter spildevandsrensningKredit:CC0 Public Domain Pesticider, farmaceutiske produkter, og hormonforstyrrende stoffer er nye forurenende stoffer, der ofte findes i renset husspildevand, selv efter sekundær behandling. Prof
Brug af elektricitet til at nedbryde forurenende stoffer efter spildevandsrensningKredit:CC0 Public Domain Pesticider, farmaceutiske produkter, og hormonforstyrrende stoffer er nye forurenende stoffer, der ofte findes i renset husspildevand, selv efter sekundær behandling. Prof -
 Hvordan påvirker temperaturen katalaseenzymaktivitet?Hydrogenperoxid er biproduktet fra adskillige biologiske processer, og for at nedbryde dette molekyle bruger kroppen et enzym kaldet katalase. Som de fleste enzymer er aktiviteten af katalase meg
Hvordan påvirker temperaturen katalaseenzymaktivitet?Hydrogenperoxid er biproduktet fra adskillige biologiske processer, og for at nedbryde dette molekyle bruger kroppen et enzym kaldet katalase. Som de fleste enzymer er aktiviteten af katalase meg -
 Knap ridser overfladen:En ny måde at lave robuste membraner påEn ny Argonne-teknik kan dyrke materiale inde i membranstrukturer, ændre deres kemi uden at påvirke poreformen markant. Dette giver forskere mulighed for at forbedre membraner på forskellige måder. Kr
Knap ridser overfladen:En ny måde at lave robuste membraner påEn ny Argonne-teknik kan dyrke materiale inde i membranstrukturer, ændre deres kemi uden at påvirke poreformen markant. Dette giver forskere mulighed for at forbedre membraner på forskellige måder. Kr -
 Vand spiller en afgørende rolle i mekanismen for Henry-reaktionen katalyseret af nye kobberkompleks…Kredit:RUDN Universitet En kemiker fra RUDN University reviderede mekanismen for Henry-reaktionen katalyseret af kobber(II)-komplekser. Dermed, ved hjælp af nye kobber(II)-komplekser opnået i samm
Vand spiller en afgørende rolle i mekanismen for Henry-reaktionen katalyseret af nye kobberkompleks…Kredit:RUDN Universitet En kemiker fra RUDN University reviderede mekanismen for Henry-reaktionen katalyseret af kobber(II)-komplekser. Dermed, ved hjælp af nye kobber(II)-komplekser opnået i samm
- Forudsætninger for livet findes allerede for 3,5 milliarder år siden
- Undersøgelse foreslår smarte suturer med sensorer til sår
- Popler genetisk modificerede for ikke at skade luftkvaliteten vokser såvel som ikke-modificerede tr…
- Sådan Graph Polynomial Funktioner
- Ny kompressor leverer impulser over 1,5 tc på cyklussen med en repetition på kilohertz
- Gør gærceller til laboratorier til undersøgelse af drivere for genregulering


