Vand spiller en afgørende rolle i mekanismen for Henry-reaktionen katalyseret af nye kobberkomplekser
Kredit:RUDN Universitet
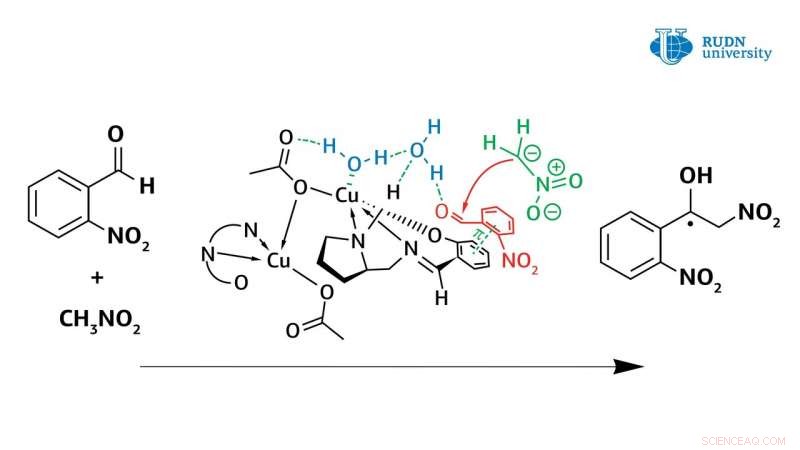
En kemiker fra RUDN University reviderede mekanismen for Henry-reaktionen katalyseret af kobber(II)-komplekser. Dermed, ved hjælp af nye kobber(II)-komplekser opnået i samme laboratorium, han viste, at vand spiller en afgørende rolle i den asymmetriske Henry-reaktion, direkte deltagelse i reaktionens katalytiske cyklus. Tidligere, denne faktor blev aldrig taget i betragtning, og videnskabsmænd troede, at kobber(II)-komplekset fungerer som en klassisk Lewis-syre.
Faktisk, kobberkomplekset i koordination med vandmolekylet aktiverer det, forvandler det til Brønstedsyre, og dermed, vandet aktiverer det oprindelige aldehyd. Data opnået fra eksperimentet giver forskere mulighed for at forstå mekanismen bag Henry-reaktionen og vil hjælpe med at skabe de vigtigste klasser af stoffer til den farmaceutiske industri:α-nitroketoner, ketoner, nitroalkener og β-aminoalkoholer. Resultaterne er publiceret i det internationale amerikanske tidsskrift Uorganisk kemi .
Den asymmetriske Henry reaktion, tillader syntese af værdifulde organiske molekyler, blev første gang udført af den japanske kemiker Masakatsu Shibasaki i 1992. Han var i stand til at udføre en reaktion med høj enantioselektivitet ved hjælp af katalysatorer baseret på kobberkomplekser. Imidlertid, før dette arbejde, der var stadig spørgsmål om mekanismen for denne reaktion. Kemiker Vladimir Larionov, en ansat ved Institut for Uorganisk Kemi ved RUDN Universitet, i eksperimenter med nye kobber(II)-komplekser, viste, at vandmolekylet spiller en afgørende rolle i Henry-reaktionen og er direkte involveret i den katalytiske cyklus. Tidligere, videnskabsmænd var ikke meget opmærksomme på dette, men kun anført det faktum, at reaktionshastigheden stiger med flere ordener med deltagelse af vand.
Disse komplekser kan bruges til at fremstille prækursorer for lægemidler såsom (S)-propranolol (β-blokker), (R)-norepinephrin og (R)-salbutamol (β-receptoragonister), amprenavir-Vertex 478 (HIV-proteasehæmmer) og L-acosamin (klasse af antracyklin-antibiotika).
Det var kendt fra tidligere undersøgelser, at den asymmetriske Henry-reaktion er bedre udført i vandige og alkoholiske opløsningsmidler. Derfor, forfatterne af undersøgelsen testede reaktionen i opløsningsmidler (methanol, aldehyd-nitromethan-vand) med to katalytiske systemer - kobolt (III) og kobber (II) komplekser. I tilfældet med koboltkomplekset, metalionen deltog ikke i reaktionen, og kobberionen kunne koordinere vandmolekylet (eller molekylerne). Reaktionen var hurtigere med kobberkomplekset, og kemikere opnåede adskillige nødvendige typer kemikalier (ligander og nitreret alkohol). Koboltkatalysator fungerede dårligere, især i fremstillingen af nitreret alkohol. Dermed, forfatterne besluttede at fokusere på kobberkatalysatoren.
Imidlertid, brugen af en kobberkatalysator i methanol gav også problemer. Dannelsen af nitreret alkohol kun af racemisk form blev observeret under kondensationen. I dette tilfælde, reaktionshastigheden aftog ikke, og blokering af kobberionens katalytiske center forekom ikke. Beregninger har vist, at vand danner en stærk binding mellem kobbercentret og carbonylgruppen. Reaktionen var afsluttet inden for en time, og udbyttet af nitreret alkohol nåede 61%. På samme tid, nitreret alkohol blev fortrængt af vand og blokerede ikke det katalytiske centrum af kobberkomplekset. Dermed, i modsætning til tidligere tanker, det blev vist, at vand forbedrer kobberkompleksernes katalytiske egenskaber.
Kemikere konkluderede, at effektiviteten af tidligere undersøgte chirale katalysatorer baseret på kobber (II) var undervurderet, fordi vand- (eller alkohol) indholdet af reaktionen ikke blev taget i betragtning og ikke blev evalueret. Denne forskning vil åbne vejen for at studere Henrys reaktionsmekanisme og skabe de nye katalytiske systemer baseret på kobberkomplekser.
 Varme artikler
Varme artikler
-
 Klarhed nødvendig i klassificeringssystemer til forarbejdede fødevarerKredit:Pixabay/CC0 Public Domain Nuværende fødevareklassifikationssystemer for forarbejdede fødevarer mangler konsistens og konsensus, der ofte fører til forvirring og debat, selv blandt forskere,
Klarhed nødvendig i klassificeringssystemer til forarbejdede fødevarerKredit:Pixabay/CC0 Public Domain Nuværende fødevareklassifikationssystemer for forarbejdede fødevarer mangler konsistens og konsensus, der ofte fører til forvirring og debat, selv blandt forskere, -
 Ingeniører laver en simpel test, der kan måle stresshormoner i sved, blod, urin eller spytUniversity of Cincinnati forskningsassistent Shima Dalirirad undersøger en maskine, der udskriver teststrimler i UCs Nanoelectronics Laboratory. Kredit:Andrew Higley/UC Creative Services Stress ka
Ingeniører laver en simpel test, der kan måle stresshormoner i sved, blod, urin eller spytUniversity of Cincinnati forskningsassistent Shima Dalirirad undersøger en maskine, der udskriver teststrimler i UCs Nanoelectronics Laboratory. Kredit:Andrew Higley/UC Creative Services Stress ka -
 Hvorfor påvirker luftfugtighed og vindhastighed fordampning?Fordampning sker, når vand skifter fra dets flydende form til dets dampform. På denne måde overføres vand fra både land- og vandmasser til atmosfæren. Cirka 80 procent af fordampningen forekommer o
Hvorfor påvirker luftfugtighed og vindhastighed fordampning?Fordampning sker, når vand skifter fra dets flydende form til dets dampform. På denne måde overføres vand fra både land- og vandmasser til atmosfæren. Cirka 80 procent af fordampningen forekommer o -
 Sådan fremstilles simuleret mavesyreMavesyre er en stærk syre, der produceres og udskilles af celler i maven. Ofte til videnskabsprojekter er du muligvis nødt til at lave en simuleret mavesyre. Dette kan hjælpe dig med at forstå, hvorda
Sådan fremstilles simuleret mavesyreMavesyre er en stærk syre, der produceres og udskilles af celler i maven. Ofte til videnskabsprojekter er du muligvis nødt til at lave en simuleret mavesyre. Dette kan hjælpe dig med at forstå, hvorda
- Ultrahøjtrykslasereksperimenter kaster lys over superjordkerner
- Parat, sæt, gå til COVID-bevidst astronauttræning
- Opbevar håndværksøl på et køligt sted og spis det så frisk som muligt
- Forskere finder guld nanopartikler i stand til at pakke DNA ud
- Daimler -overskud ramt af dieselskandale
- To milliarder år gammel saltsten afslører iltstigning i gammel atmosfære


