Ny proces kunne gøre brintoverilte tilgængelig på fjerntliggende steder
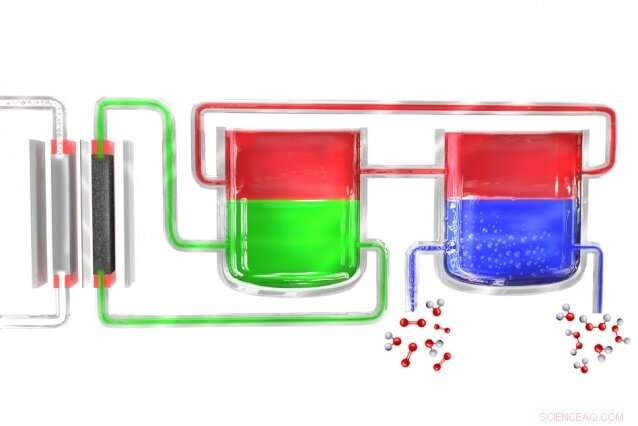
I en ny metode til at producere hydrogenperoxid bærbart, en elektrolysator (til venstre) spalter vand til brint og ilt. Brintatomerne dannes oprindeligt i et elektrolytmateriale (grønt), som overfører dem til et mediatormateriale (rødt), som derefter fører dem til en separat enhed, hvor mediatoren kommer i kontakt med iltrigt vand (blåt), hvor brinten kombineres med det og danner hydrogenperoxid. Mediatoren vender derefter tilbage for at starte cyklussen igen. Kredit:Massachusetts Institute of Technology
Brintoverilte, et nyttigt desinfektionsmiddel til alle formål, findes i de fleste medicinskabe i den udviklede verden. Men i fjerntliggende landsbyer i udviklingslande, hvor det kunne spille en vigtig rolle inden for sundhed og sanitet, det kan være svært at komme forbi.
Nu, en proces udviklet på MIT kunne føre til en enkel, billig, bærbar enhed, der kunne producere brintoverilte kontinuerligt fra kun luft, vand, og el, giver en måde at sterilisere sår på, overflader til madlavning, og endda vandforsyninger.
Den nye metode er beskrevet i denne uge i journalen Joule i et papir af MIT-studerende Alexander Murray, Sahag Voskian, og Marcel Schreier og MIT-professorerne T. Alan Hatton og Yogesh Surendranath.
Selv ved lave koncentrationer, hydrogenperoxid er et effektivt antibakterielt middel, og efter at have udført sin steriliseringsfunktion nedbrydes den til almindeligt vand, i modsætning til andre midler såsom klor, der kan efterlade uønskede biprodukter fra dets produktion og brug.
Hydrogenperoxid er bare vand med et ekstra iltatom påsat - det er H2O2, i stedet for H2O. Den ekstra ilt er relativt løst bundet, hvilket gør det til et meget reaktivt kemikalie, der er ivrig efter at oxidere andre molekyler omkring det. Det er så reaktivt, at det i høje koncentrationer kan bruges som raketbrændstof, og selv koncentrationer på 35 procent kræver meget specielle håndterings- og forsendelsesprocedurer. Den slags, der bruges som husholdningsdesinfektionsmiddel, er typisk kun 3 procent brintoverilte og 97 procent vand.
Fordi høje koncentrationer er svære at transportere, og lave koncentrationer, er for det meste vand, er uøkonomiske at sende, materialet er ofte svært at få på steder, hvor det kunne være særligt nyttigt, såsom fjerntliggende samfund med ubehandlet vand. (Bakterier i vandforsyninger kan effektivt kontrolleres ved at tilsætte brintoverilte.) Som følge heraf, mange forskningsgrupper rundt om i verden har forfulgt tilgange til at udvikle en eller anden form for bærbart hydrogenperoxidproduktionsudstyr.
Det meste af det brintoverilte, der produceres i den industrialiserede verden, fremstilles i store kemiske fabrikker, hvor metan, eller naturgas, bruges til at tilvejebringe en brintkilde, som derefter reageres med oxygen i en katalytisk proces under høj varme. Denne proces er energikrævende og ikke let skalerbar, kræver stort udstyr og en konstant forsyning af metan, så det egner sig ikke til mindre enheder eller fjerntliggende steder.
"Der er et voksende samfund, der er interesseret i bærbart brintoverilte, " Surendranath siger, "på grund af påskønnelse af, at det virkelig ville opfylde en masse behov, både på den industrielle side såvel som med hensyn til menneskers sundhed og sanitet."
Andre processer, der hidtil er udviklet til potentielt bærbare systemer, har vigtige begrænsninger. For eksempel, de fleste katalysatorer, der fremmer dannelsen af brintoverilte fra brint og oxygen, laver også meget vand, fører til lave koncentrationer af det ønskede produkt. Også, processer, der involverer elektrolyse, som denne nye proces gør, har ofte svært ved at adskille den producerede brintoverilte fra det elektrolytmateriale, der anvendes i processen, igen fører til lav effektivitet.
Surendranath og resten af teamet løste problemet ved at dele processen ned i to separate trin. Først, elektricitet (ideelt fra solceller eller vindmøller) bruges til at nedbryde vand til brint og ilt, and the hydrogen then reacts with a "carrier" molecule. This molecule—a compound called anthroquinone, in these initial experiments—is then introduced into a separate reaction chamber where it meets with oxygen taken from the outside air, and a pair of hydrogen atoms binds to an oxygen molecule (O2) to form the hydrogen peroxide. In the process, the carrier molecule is restored to its original state and returns to carry out the cycle all over again, so none of this material is consumed.
The process could address numerous challenges, Surendranath says, by making clean water, first-aid care for wounds, and sterile food preparation surfaces more available in places where they are presently scarce or unavailable.
"Even at fairly low concentrations, you can use it to disinfect water of microbial contaminants and other pathogens, " Surendranath says. And, tilføjer han, "at higher concentrations, it can be used even to do what's called advanced oxidation, " where in combination with UV light it can be used to decontaminate water of even strong industrial wastes, for example from mining operations or hydraulic fracking.
Så, for eksempel, a portable hydrogen peroxide plant might be set up adjacent to a fracking or mining site and used to clean up its effluent, then moved to another location once operations cease at the original site.
In this initial proof-of-concept unit, the concentration of hydrogen peroxide produced is still low, but further engineering of the system should lead to being able to produce more concentrated output, Surendranath says. "One of the ways to do that is to just increase the concentration of the mediator, and fortunately, our mediator has already been used in flow batteries at really high concentrations, so we think there's a route toward being able to increase those concentrations, " han siger.
"It's kind of an amazing process, " han siger, "because you take abundant things, vand, air and electricity, that you can source locally, and you use it to make this important chemical that you can use to actually clean up the environment and for sanitation and water quality."
"The ability to create a hydrogen peroxide solution in water without electrolytes, salt, base, etc., all of which are intrinsic to other electrochemical processes, is noteworthy, " says Shannon Stahl, a professor of chemistry at the University of Wisconsin, som ikke var involveret i dette arbejde. Stahl adds that "Access to salt-free aqueous solutions of H2O2 has broad implications for practical applications."
Stahl says that "This work represents an innovative application of 'mediated electrolysis.' Mediated electrochemistry provides a means to merge conventional chemical processes with electrochemistry, and this is a particularly compelling demonstration of this concept. … There are many potential applications of this concept."
Denne historie er genudgivet med tilladelse fra MIT News (web.mit.edu/newsoffice/), et populært websted, der dækker nyheder om MIT-forskning, innovation og undervisning.
 Varme artikler
Varme artikler
-
 Hvorfor er kulstof så vigtig for organiske forbindelser?Organiske forbindelser er dem, som livet afhænger af, og de indeholder alle kulstof. Faktisk er definitionen af en organisk forbindelse en, der indeholder kulstof. Det er det sjette mest rigelige
Hvorfor er kulstof så vigtig for organiske forbindelser?Organiske forbindelser er dem, som livet afhænger af, og de indeholder alle kulstof. Faktisk er definitionen af en organisk forbindelse en, der indeholder kulstof. Det er det sjette mest rigelige -
 Nye materialer hjælper med at udvide volumetrisk 3-D-printVed hjælp af en tilpasset volumetrisk additiv fremstilling 3D-printer, Lawrence Livermore-forskere var i stand til at bygge hårde og stærke, samt strækbar og fleksibel, genstande næsten øjeblikkeligt
Nye materialer hjælper med at udvide volumetrisk 3-D-printVed hjælp af en tilpasset volumetrisk additiv fremstilling 3D-printer, Lawrence Livermore-forskere var i stand til at bygge hårde og stærke, samt strækbar og fleksibel, genstande næsten øjeblikkeligt -
 Producerer grønt brint ved udsættelse af nanomaterialer for sollysSe gennem et vindue af det indre af en ultrahøj vakuumreaktor, hvor TiO2-nanorør er dekoreret med CoO-nanopartikler. Vi ser flammen (plasma produceret ved laserablation), der sprutter CoOet for at giv
Producerer grønt brint ved udsættelse af nanomaterialer for sollysSe gennem et vindue af det indre af en ultrahøj vakuumreaktor, hvor TiO2-nanorør er dekoreret med CoO-nanopartikler. Vi ser flammen (plasma produceret ved laserablation), der sprutter CoOet for at giv -
 Leuphana-forskere udvikler miljøvenligere antibiotikaKredit:Leuphana Universität Lüneburg Holdet ledet af professor Dr. Klaus Kümmerer er nu lykkedes med at udvikle antibiotika af denne klasse af stoffer, som bliver uskadelige i miljøet ved naturlig
Leuphana-forskere udvikler miljøvenligere antibiotikaKredit:Leuphana Universität Lüneburg Holdet ledet af professor Dr. Klaus Kümmerer er nu lykkedes med at udvikle antibiotika af denne klasse af stoffer, som bliver uskadelige i miljøet ved naturlig
- Smeltende havis kan fremskynde naturens ur i Arktis
- Hvorfor vi lavede iWitnessed, en app til at indsamle beviser
- Aktieoptioner mere værd for kvinder, øverste ledere, undersøgelse finder
- Great Barrier Reef, et aktiv på $42 milliarder, der er for stort til at mislykkes:studie
- Norges Telenor dropper Huawei for Ericsson i 5G-kontrakt
- Infrarøde øjne på Enceladus:Antydninger af frisk is på den nordlige halvkugle


