Proteinændringer går forud for fotoisomerisering af retinal kromofor
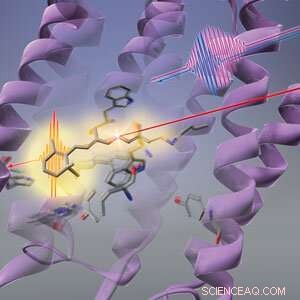
Figur 1:RIKEN-forskere har fundet ud af, at lys (lang rød linje) først får proteinets form (lilla hvirvler) til at ændre sig, før den retinale kromofor (stick-lignende struktur) i bacteriorhodopsin gennemgår fotoisomerisering. © 2019 RIKEN Center for Avanceret Fotonik
Sekvensen af ændringer, som lys udløser i en bakteriel fotoreceptor, starter med dens proteinstillads snarere end den lysabsorberende kromofor, et all-RIKEN hold har vist. Denne opdagelse går imod konventionel visdom og kaster nyt lys over, hvordan fotoreceptorer så effektivt kan omdanne lys til kemisk energi.
Mange bakterier bruger specielle lysfølsomme molekyler kendt som fotoreceptorproteiner til at omdanne lys til kemisk energi, som de bruger til at igangsætte forskellige biologiske funktioner.
Forskere har længe ønsket at vide, hvordan bakterielle fotoreceptorer er så effektive til at omdanne lys. "Et af de grundlæggende spørgsmål er, hvordan disse biomolekyler realiserer så høj effektivitet, lavenergi fotoreaktioner, " siger Tahei Tahara. "Dette har været et langvarigt spørgsmål." En motivation for at afdække mekanismen for disse fotoreceptorer er, at det kunne informere bestræbelserne på at udvikle kunstige versioner af disse molekyler.
Den mest velundersøgte bakterielle fotoreceptor, bakteriodopsin, indeholder en retinal kromofor, som ændrer form, når den absorberer en foton af gult lys. Denne konfigurationsændring sætter gang i en række strukturelle ændringer i bacteriorhodopsin, der gør det i stand til at pumpe protoner.
Interessant nok, når den retinale kromofor af bacteriorhodopsin placeres i opløsning, dens lysomdannelseseffektivitet er tre gange lavere, end når den er indlejret i proteinstrukturen af bacteriorhodopsin. Dette indikerer tydeligt, at proteinet spiller en vigtig rolle i at hjælpe med omdannelsen af lys til kemisk energi.
Den konformationelle ændring af den retinale kromofor blev antaget at være den første reaktion af bacteriorhodopsin på lys. Men Tahara og hans medarbejdere ved RIKEN Molecular Spectroscopy Laboratory og RIKEN Center for Advanced Photonics har nu opdaget, at der er et trin, der går forud for det - proteinet, der vugger nethindens kromofor, ændrer først sin form som reaktion på lys. Denne ændring i proteinet kunne hjælpe den retinale kromofor med at bruge lys effektivt.
Holdet tog en spektroskopisk teknik kendt som femtosekund-stimuleret Raman-spektroskopi, som kan observere processer, der sker hurtigere end et picosekund (1 picosekund =10-12 sekunder), og udvidede det til det dybe ultraviolette område. Dette gjorde det muligt for dem at se på proteindelen af bacteriorhodopsin.
Denne opdagelse kom som en overraskelse for Tahara. "Jeg havde ikke forventet, at proteinet ville ændre form før kromoforisomerisering, men da jeg så de eksperimentelle resultater, tænkte jeg "Wow, det er faktisk tilfældet, " siger han. "Det var meget overraskende, og vi var meget spændte."
Mens holdet så på bacteriorhodopsin i denne undersøgelse, de forudser, at den samme virkning godt kunne forekomme i andre rhodopsiner.
 Varme artikler
Varme artikler
-
 Magneter adskiller blandinger af sjældne jordarters metaller bæredygtigtKredit:CC0 Public Domain En ny undersøgelse beskriver en ny tilgang til rensning af sjældne jordarters metaller, afgørende komponenter af teknologi, der kræver miljøskadelige minedriftsprocedurer.
Magneter adskiller blandinger af sjældne jordarters metaller bæredygtigtKredit:CC0 Public Domain En ny undersøgelse beskriver en ny tilgang til rensning af sjældne jordarters metaller, afgørende komponenter af teknologi, der kræver miljøskadelige minedriftsprocedurer. -
 Nye kemiske forbindelser gør katalysatorer mere effektiveForskergruppen fra Bochum:Thorsten Scherpf, Viktoria Daeschlein-Gessner, Lennart Scharf og Christopher Schwarz (fra venstre). Kredit:RUB, Marquard Et team fra Chair of Inorganic Chemistry II ved R
Nye kemiske forbindelser gør katalysatorer mere effektiveForskergruppen fra Bochum:Thorsten Scherpf, Viktoria Daeschlein-Gessner, Lennart Scharf og Christopher Schwarz (fra venstre). Kredit:RUB, Marquard Et team fra Chair of Inorganic Chemistry II ved R -
 Forskere bestemmer, hvordan alfavirus ændrer sig til infektiøs tilstandKryoelektronmikroskopi rekonstruktion af Chikungunya virus. Fra EMDB-indgang 5577. Kredit:Wikipedia Et nøgletrin i den infektiøse metode for en familie af sygdomsfremkaldende vira er blevet identi
Forskere bestemmer, hvordan alfavirus ændrer sig til infektiøs tilstandKryoelektronmikroskopi rekonstruktion af Chikungunya virus. Fra EMDB-indgang 5577. Kredit:Wikipedia Et nøgletrin i den infektiøse metode for en familie af sygdomsfremkaldende vira er blevet identi -
 Fra kompost til kompositter:En miljøvenlig måde at forbedre gummi påKredit:American Chemical Society Begrebet fra skrald til skat gælder for komposteringens verden, hvor madaffald genanvendes til gødning til haver. Men hvad nu hvis kompost kunne gå ud over gødning
Fra kompost til kompositter:En miljøvenlig måde at forbedre gummi påKredit:American Chemical Society Begrebet fra skrald til skat gælder for komposteringens verden, hvor madaffald genanvendes til gødning til haver. Men hvad nu hvis kompost kunne gå ud over gødning
- Sådan laver du et klasseværelse Palm Tree
- En alsidig, ren og effektiv måde at forbedre udbredt anvendelse af carbon nanorør
- Galaktisk vindkvælende stjernedannelse er den fjerneste hidtil set
- Tre gamle skeletter, forfædre til kæmpe dinosaurer, udgravet i Brasilien
- Surtrac tillader trafikken at bevæge sig med teknologiens hastighed
- Et gennembrud i estimering af størrelsen af et (for det meste skjult) netværk


