Ny patogen mekanisme for influenza NS1-protein fundet

Naturligt forekommende mutationer kan give fingerpeg om mekanismer for viral patogenese. Kredit:University of Alabama i Birmingham
Influenza er en dødelig virus, med omkring 290, 000 til 650, 000 dødsfald på verdensplan hvert år. Når pandemier rammer, vejafgiften kan stige:Den spanske syge i 1918 forårsagede 40 millioner til 50 millioner dødsfald, den asiatiske influenza i 1957 forårsagede 2 millioner dødsfald, og Hong Kong-influenzaen i 1968 forårsagede 1 million dødsfald.
Chad Petit, Ph.D., og kolleger ved University of Alabama i Birmingham bekæmper influenza på molekylært niveau, dels ved at finde naturlige mutationer i det virale RNA-genom, der har en funktionel påvirkning under infektion. At opdage, hvordan virussen bruger disse ukendte mekanismer til at forhindre din krop i at opbygge et effektivt forsvar mod infektion, Petit sagde, "vil bedre forberede os til at forudsige det pandemiske potentiale af influenza A-virus og hjælpe med udviklingen af vacciner og antivirale midler."
Influenza A er farlig, fordi den hvert år tilpasser sig forskellige værter og gennemgår genetisk reassortering. Dette genererer en konstant strøm af unikke stammer, der har ukendte grader af patogenicitet, overførbarhed og evne til at forårsage internationale pandemier.
Petits seneste forskning, offentliggjort i Journal of Biological Chemistry , tager et detaljeret kig på en naturligt forekommende mutation i en influenza-stamme fra et russisk udbrud i 1972, som UAB-holdet beskrev i 2015, mens man sammenligner den russiske stamme med stammen fra 1918, der var ansvarlig for den spanske syge.
Mutationen er i influenzaproteinet NS1. I 2015 Petit og hans UAB-kolleger var de første til at vise, at NS1 fra 1918-stammen havde en direkte interaktion med RIG-I, cellens hovedsensor til at opdage influenzavirusinfektion og derefter starte et medfødt immunforsvar. Desuden, den del af 1918 NS1 RNA-bindingsdomænet, der bandt til RIG-I, havde ingen tidligere kendt funktion. I modsætning til 1918 NS1, Petits laboratorium fandt ud af, at NS1 fra influenza A-stammen 1972 Udorn ikke var i stand til at binde til RIG-I-stedet, der interagerede med 1918 NS1.
Nu, Petit og kolleger rapporterer om de biologiske virkninger af NS1-binding til RIG-I - bindingen dæmper direkte alarmen, der aktiverer det cellulære medfødte immunforsvar mod infektionen. Dette er en nyligt beskrevet måde at antagonisere værtscellulære antivirale respons.
"NS1 er næsten som den schweiziske hærkniv af proteiner, fordi den har så mange funktioner, sagde Petit, en adjunkt i UAB Institut for Biokemi og Molekylær Genetik. NS1 ser ud til at interagere med 20 til 30 værtsproteiner, og sammenlignet med andre influenzaproteiner, NS1 har også bemærkelsesværdig genetisk plasticitet, hvilket betyder, at dets virkning på virulens kan variere mellem stammer.
Studiedetaljer
Mutationen i Udorn NS1-proteinet er en ændring af en enkelt aminosyre i position 21 fra arginin til glutamin. I den aktuelle forskning, UAB-forskerne brugte omvendt genetik til at konstruere denne mutation til en Puerto Rico-influenza-stamme fra 1934, og derefter sammenlignede de, hvordan vildtype-NS1- og mutant-NS1-proteinerne fungerede.
Ved hjælp af en række molekylærbiologiske værktøjer, UAB-forskerne fandt ud af, at mens vildtypen NS1 antagoniserer RIG-I-signalering for at starte alarmsekvensen, mutanten NS1 tillod denne signalering. Specifikt, mutanten NS1 var signifikant mindre i stand til at binde til RIG-I, som tillod udløsningen af medfødt immunitet - især ved at øge TRIM-25 ubiquitinering af RIG-I, hvilket er det kritiske trin for at aktivere RIG-I. Det førte til øget IRF3-phosphorylering og øget produktion af type I-interferon.
Imidlertid, den ændrede aminosyre i mutanten NS1 havde ingen effekt på to andre kendte måder, hvorpå NS1 kan blokere det cellulære medfødte immunitetsrespons - binding til dobbeltstrenget RNA og binding med TRIM-25 cellulære protein. Dermed, Petit og kolleger har beskrevet et yderligere værktøj på NS1 til at øge viral overlevelse.
Men UAB-forskerne står tilbage med et særligt udestående spørgsmål - hvorfor forekommer arginin-til-glutamin-mutationen ved aminosyre-21 naturligt, hvis den fører til en øget antiviral respons under infektion? Dette virker kontraintuitivt med hensyn til evolution.
Sammenligning af flere NS1-sekvenser i Influenza Research Database, Petit siger, tyder på, at de forskellige aminosyrer i position 21 kan relateres til artsspecifik tilpasning. Flere stammer af influenza A fra mennesker var 63 procent arginin og 36,7 procent glutamin ved aminosyre-21; stammer fra svin var 92,1 procent arginin og 6,4 procent glutamin; og stammer fra fugle var 79,9 procent arginin, 0,8 procent glutamin og 19,1 procent leucin. Der var små procentdele af andre aminosyrer blandt stammerne i position 21.
Der er en slående forskel mellem to humane serotyper, der forårsager sæsonbetinget sygdom, og to humane serotyper, der er mere højpatogene. De to sæsonbestemte serotyper, H1N1 og H3N2, var 75,4 procent arginin og 24,5 procent glutamin, og 1 procent arginin og 98,8 procent glutamin, henholdsvis, i position 21. De to højpatogene stammer, H5N1 og H7N9, var 100 procent arginin og 0 procent glutamin, og 95,9 procent arginin og 2,3 procent glutamin, henholdsvis, i position 21. Der var små procenter af andre aminosyrer for H7N9-stammerne i position 21.
"Taget sammen, arbejdet præsenteret i denne undersøgelse, " Petit sagde, "understreger vigtigheden af, hvordan stammespecifikke polymorfier i NS1 kan påvirke dets evne til at modvirke værtens cellulære immunrespons på måder, der endnu ikke er værdsat."
Sidste artikelUndervurderet kemisk mangfoldighed
Næste artikelPolymerer til undsætning! Redder celler fra at beskadige is
 Varme artikler
Varme artikler
-
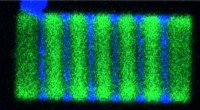 Ny klasse af bløde halvledere kunne transformere HD-skærmeEn 2-D plade, der viser skiftevis cæsium blychlorid (blå) og cæsium blybromid (grøn) segmenter. Kredit:Letian Dou/Berkeley Lab og Connor G. Bischak/UC Berkeley En ny type halvleder kan være på vej
Ny klasse af bløde halvledere kunne transformere HD-skærmeEn 2-D plade, der viser skiftevis cæsium blychlorid (blå) og cæsium blybromid (grøn) segmenter. Kredit:Letian Dou/Berkeley Lab og Connor G. Bischak/UC Berkeley En ny type halvleder kan være på vej -
 Undersøgelse identificerer de mest lovende råvarer til pyrolysebaseret bioraffinaderiKredit:CC0 Public Domain En undersøgelse af sammensætningen og forarbejdeligheden af forskellige biomasseråstoffer har fundet ud af, at solsikkefrøskaller og poppeltræplader er de bedst egnede t
Undersøgelse identificerer de mest lovende råvarer til pyrolysebaseret bioraffinaderiKredit:CC0 Public Domain En undersøgelse af sammensætningen og forarbejdeligheden af forskellige biomasseråstoffer har fundet ud af, at solsikkefrøskaller og poppeltræplader er de bedst egnede t -
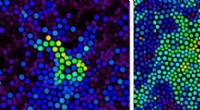 Dissektering af kolloidale briller ved hjælp af laser som lancetTypiske excitationsmønstre ved forskellige pakningsfraktioner. Gengivet fra fig. ~ 1b-d i naturen, 11. november 2020 (online). Kredit:IBS Bo Li og Kai Kou, Research Fellows fra IBS Center for Soft
Dissektering af kolloidale briller ved hjælp af laser som lancetTypiske excitationsmønstre ved forskellige pakningsfraktioner. Gengivet fra fig. ~ 1b-d i naturen, 11. november 2020 (online). Kredit:IBS Bo Li og Kai Kou, Research Fellows fra IBS Center for Soft -
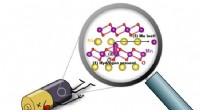 Mod et bedre batteri:Forskere afslører kilde til nedbrydning i natriumbatterierEn illustration viser hydrogen-induceret nedbrydning af et natrium-ion-batteri:(1) Når brint er til stede (cirklet med sort), (2) et Mn-atom (lilla) kan bevæge sig fra MnO2-laget til Na-laget (gult);
Mod et bedre batteri:Forskere afslører kilde til nedbrydning i natriumbatterierEn illustration viser hydrogen-induceret nedbrydning af et natrium-ion-batteri:(1) Når brint er til stede (cirklet med sort), (2) et Mn-atom (lilla) kan bevæge sig fra MnO2-laget til Na-laget (gult);
- Skalerbar fotonisk computer løser delsættet sumproblem
- Biologisk inspireret membran renser kulfyret røg for drivhusgasser
- Hvordan forsvinder havet, når en orkan passerer?
- Ny platform til at skabe og karakterisere materialeblandinger kan fremskynde udviklingen markant
- Kunstig intelligens system bruger gennemsigtige, menneskelignende ræsonnement for at løse probleme…


