Team belyser mikro-miljøet, at skabe en ny vej til kræftmedicin
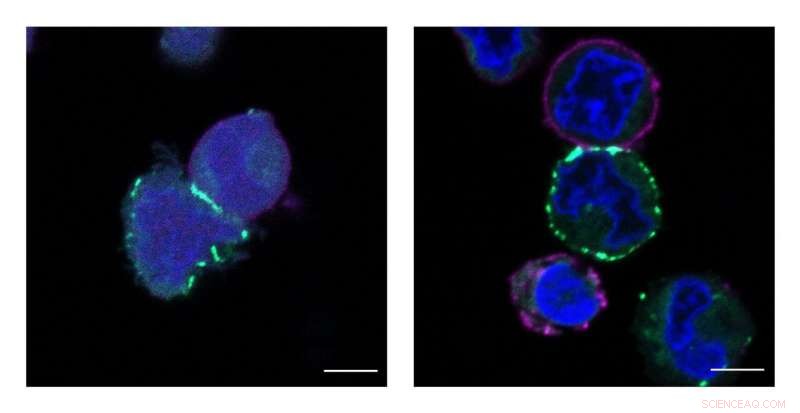
Princetons MacMillan Group udviklede en ny teknologi kaldet μMap, der identificerer proteiners nærmeste naboer på celleoverflader. Disse billeder viser celler, der mærkes, eller markeret med grønt, af μMap -katalysatoren. Kredit:Tamara Reyes-Robles/Merck Exploratory Science Center
Da virksomhedspartnere i Princeton Catalysis Initiative for to år siden satte sig sammen med David MacMillan, de præsenterede ham for en biologisk udfordring i hjertet af potentielle kræftmedicin og andre terapeutiske midler:Hvilke proteiner på en celles overflade rører hinanden?
Det, de ønskede, var analogt med et søgelys, der flammede ind i en mørk hule - noget for at skinne et metaforisk lys på et protein og dets nærmeste naboer på cellemembranen. Stor, komplekse molekyler, proteiner er livets ting, selve omdrejningspunktet, som alt ved os drejer sig om - den måde, vi tænker på, den måde, vi vokser på, de sygdomme, vi får. Proteiner er i stand til at bestemme dette ved at sende beskeder til deres naboer. Men mens forskere tidligere kunne fortælle, hvem der var inde i hulen, de kunne ikke se hvem der stod ved siden af hvem, og manglede derfor vigtig viden om disse essentielle protein-til-protein-kommunikationer.
Kemisk Institut MacMillan Group annoncerede i det aktuelle nummer af Videnskab at de har udviklet det søgelys.
Den banebrydende teknologi, navngivet μMap af teamet af Princeton -forskere og Merck -forskere, bruger en fotokatalysator - et molekyle, der, når den aktiveres af lys, fremkalder en kemisk reaktion - til at identificere rumlige forhold på celleoverflader. Katalysatoren genererer en markør, der mærker proteiner og deres molekylære naboer, hvilket igen muliggør en præcis kortlægning af deres mikro-miljø.
Teknologien kan påvirke proteomik, genomik og neurovidenskab, for at nævne nogle af de mere oplagte felter. Men ansøgningerne om fundamental biologi er så vidtgående, at MacMillan, hvem er Princetons James S. McDonnell Distinguished University Professor i kemi, er sulten efter at få teknologien "i alles hænder" for at se, hvad forskere på andre områder kan finde på.
"For de teknologier, vi har lige nu, problemet er ikke, om du kan tagge ting, "sagde han." Problemet er, at du kan mærke tusindvis af ting, og så du ikke kan fortælle, hvad der er derude, og hvad der er lige ved siden af. Det viser sig virkelig at være virkelig vigtigt, fordi molekyler eller proteiner eller enzymer, der signalerer hinanden, normalt er lige ved siden af hinanden. Godt, den topmoderne fortæller dig ikke, hvad der er tæt på. "
Så de kom med en radikal ny tilgang.
"Vi lavede nogle kritiske eksperimenter, og med det samme kunne vi vise, at vi mærkede ting inden for en virkelig kort afstand, "Sagde MacMillan." Vi ved nu præcis, hvad der er i nabolaget. Og det er aldrig blevet gjort før. For biologi, det vil være som at tænde lyskontakten og pludselig se alt. "
Merck Exploratory Science Center (MESC) forskere Rob Oslund og Olugbeminiyi Fadeyi, medforfattere af papir, der er baseret i Cambridge, Massachusetts, sagde, at teknologien kunne inspirere til store nye udviklinger inden for biologi. "I betragtning af den vigtige rolle at forstå proteininteraktioner inden for cellulære mikromiljøer, "Sagde Oslund, "denne teknologi har potentiale til at være et spil-skiftende værktøj for både akademiske og industrielle life science-laboratorier over hele verden."
ΜMap, udtalt mikrokort, identificerer naboer inden for en radius på 1 til 10 nanometer omkring et bestemt protein. (Til reference, et menneskehår er omkring 100, 000 nanometer på tværs.) Opløsning på dette niveau identificerer de 10 eller 15 nærmeste molekyler.
Jacob Geri, en postdoktor i Merck Center for Catalysis ved Princeton University og en co-first-author på Videnskab papir med kandidatstuderende James Oakley og MESC-videnskabsmand Tamara Reyes-Robles, sagde μMap gør dette ved at bruge blåt lys til at drive en katalytisk reaktion.
Sådan fungerer det:Katalysatoren - i dette tilfælde, en organisk metalforbindelse - er selektivt knyttet til en af omkring 40, 000 proteiner på en celles overflade, hvor den fungerer som en slags antenne. Blåt lys, som har en meget høj fotonisk energi, fungerer som udløser. Når det lyste på cellen, dette blå lys opsamles af antennen, som omdanner sin fotoniske energi til kemisk energi. Den latente energi køler ikke; det diffunderer ikke; den vandrer ikke formålsløst langs cellemembranen og maler alt, hvad den støder på. Den sidder bare.
Baseret på et papir udgivet for omkring 40 år siden, MacMillans gruppe kom på ideen om at anvende brugen af et organisk molekyle kaldet et diazirin, der er særligt modtageligt for denne latente energi. Når en diazirin bevæger sig meget tæt på katalysatoren - inden for 0,1 nanometer - overføres den kemiske energi til diazirinen. Diazirinet reagerer igen så voldsomt, at det frigiver et biprodukt og bliver det, der omtales som en carbene, en "vred" art, der knytter sig til naboproteiner.
"Katalysatoren overfører så meget energi, at molekylet river sig i stykker for at afsløre et utroligt ustabilt carbonatom, som så bare holder sig til alt det kan, "forklarede Geri.
Katalysatoren kan udføre denne kemiske reaktion mange gange, så processen gentager sig for alle lokaliserede molekyler, proteiner og enzymer. Fordi carbener er så korte-bare et par nanosekunder-giver deres reaktion en levende, øjebliksbillede i realtid af alle sammenhængende molekyler. Efterfølgende, forskere kan quilt sammen et præcist kort over mikromiljøet-netop den teknologi forskere ledte efter.
"A lot of the mechanism of disease takes place through how these cells talk to each other, and they can only talk if they're touching, " said Geri. "That's why the surface of the cell is so important. If they touch, they can communicate."
He added:"We can now figure out what's making that communication happen or what's making that communication change. It's really been an amazing experience, working on this."
MacMillan's group chose two categories of human cells to investigate. One was a class of proteins that had known interactions, selected as a kind of control group to prove that their interactions could be captured by μMap. The second group was "more interesting, " said Geri. It centered on proteins called PD-L1 and PD-1, which are associated with the body's immune system and its response to cancer cells.
Normalt, sick cells like cancer cells would present as molecular interlopers that need to be cleared by the immune system. But cancer cells are deceptive, said MacMillan. They send out a "don't kill me" signal through a cloaking mechanism involving the PD-L1 and PD-1 axis. Since cancer therapies are successful partly based on their capacity to block that signal, scientists want to know more about how it is transmitted. Mapping the precise neighborhood is an essential early step. When researchers put the μMap catalyst on PD-L1 and PD-1, the molecules in their micro-environment are tagged. Protein-protein interactions that had previously been hypothesized could now be directly observed. And several correlations were detected that had never been conceived of.
"Nu, we don't do the cancer biology, " said MacMillan. "But we've invented this tool that can give you a lot of information about these cancer cells. We think that by using this information, you can start to target those proteins as a way to also remove interfering signals. And if you can remove those signals, you make your immune system better at going after these cancer cells."
Soon after MacMillan arrived at Princeton, he began driving research in harnessing blue LED light to perform previously impossible feats of chemistry. Merck became involved in 2006, with a seed donation toward MacMillan's research. The company has since donated additional monies, and in 2019 they announced a 10-year funding commitment towards the Princeton Catalysis Initiative, which fosters interdisciplinary collaborations to accelerate the discovery of new research areas.
"Our collaboration created a novel cellular chemistry approach leveraging photoredox catalysis to activate diazirines, an important class of organic molecules, in a temporal-controlled manner, " said Merck's Fadeyi. "Because of the routine use of diazirines within chemical biology and biology, this method will be in high demand not only for protein labeling, but for identifying the binding targets of other biomolecules to elucidate their functional roles."
He added:"The collaboration was successful due to the close interactions between Merck scientists and Dave's lab."
MacMillan likewise lauded the discovery as proof of the value of collaboration across academic and industry lines, like those envisioned when the Princeton Catalysis Initiative first came into being in 2018.
"Som kemikere, we don't know any good questions in biology—zero, "sagde han." Så, you're taking these people who know everything about biology, and they have this problem that they're trying to solve. And it's ultimately a great problem for a chemistry group. På samme tid, it's not a problem that a chemistry group would ever think about because they don't know biology. You have these two different areas and you put them together and you start to realize there all these great things you can do.
"This is what I love about the social science of science, " he added. "It is absolutely a beautiful example of how it took a village to solve a problem."
 Varme artikler
Varme artikler
-
 Undersøgelse sår tvivl om nøjagtigheden af mobile stoftestanordningerKredit:CC0 Public Domain Ny forskning udført af Lambert Initiative for Cannabinoid Therapeutics ved University of Sydney sætter spørgsmålstegn ved pålideligheden af de to enheder, der i øjeblikk
Undersøgelse sår tvivl om nøjagtigheden af mobile stoftestanordningerKredit:CC0 Public Domain Ny forskning udført af Lambert Initiative for Cannabinoid Therapeutics ved University of Sydney sætter spørgsmålstegn ved pålideligheden af de to enheder, der i øjeblikk -
 Undersøgelse detaljerede regulering af en multi-drug transporter(venstre mod højre):Reza Dastvan, Ph.d., Smriti Mishra, Ph.d., og Hassane Mchaourab, Ph.d., studerer den indre funktion af en proteinpumpe, der bidrager til kemoterapiresistens mod kræft. Kredit:Vande
Undersøgelse detaljerede regulering af en multi-drug transporter(venstre mod højre):Reza Dastvan, Ph.d., Smriti Mishra, Ph.d., og Hassane Mchaourab, Ph.d., studerer den indre funktion af en proteinpumpe, der bidrager til kemoterapiresistens mod kræft. Kredit:Vande -
 Ny teknik kan hjælpe med at konstruere forurenet vandfilter, menneskeligt vævBlomstformede biomaterialer ved hjælp af konstruerede proteinbyggesten. Kredit:Nancy Hernandez, William Hansen og Slava Manichev Forskere kan forvandle proteiner til uendelige mønstre, der ligner
Ny teknik kan hjælpe med at konstruere forurenet vandfilter, menneskeligt vævBlomstformede biomaterialer ved hjælp af konstruerede proteinbyggesten. Kredit:Nancy Hernandez, William Hansen og Slava Manichev Forskere kan forvandle proteiner til uendelige mønstre, der ligner -
 Eksempler på fordampning og kondensationKondensation og fordampning er to processer, hvorved stof ændrer fase. Kondensation er overgangen fra en gasfase til en flydende eller fast fase. Fordampning er på den anden side overgangen fra væske
Eksempler på fordampning og kondensationKondensation og fordampning er to processer, hvorved stof ændrer fase. Kondensation er overgangen fra en gasfase til en flydende eller fast fase. Fordampning er på den anden side overgangen fra væske
- Princippet, der styrer alt fra raketlandinger til renter
- Sådan gør du meningsmålinger mere repræsentative og ærlige
- Grafenoxid nedbrydes biologisk ved hjælp af humane enzymer
- Standardformular for en linje
- Det første skridt til at vælge det rigtige college? Ignorer placeringen
- Intracellulære optagelser ved hjælp af nanotårnelektroder


