Røntgenøjne kigger dybere ind i dødbringende patogen
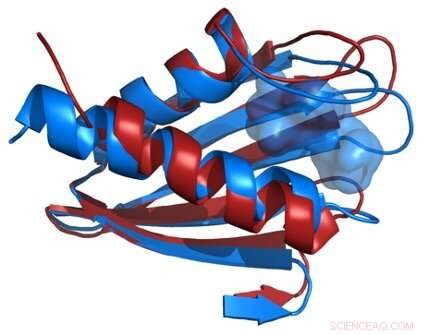
Sammenligning af strukturerne af Flpp3-proteinrygraden som afledt af en røntgenfri elektronlaser (rød) og fra NMR (blå) afslører et indre hulrum, der er unikt for NMR-strukturen og antyder derfor eksistensen af mellemliggende proteinstrukturer. Kredit:James Zook
Tularæmi er en sjælden, men ofte dødelig sygdom. Det er forårsaget af en af de mest aggressive patogener på jorden, bakterien Francisella tularensis. Mikroben, transporteret af en række forskellige dyr og insekter, er i stand til at komme ind i og angribe kroppen gennem en række veje, resulterer i forskellige konstellationer af symptomer og sværhedsgrader.
Tularæmi er stadig dårligt forstået, og der findes ingen sikker og effektiv vaccine mod sygdommen. Den ekstreme dødelighed af F. tularensis og dens potentiale til at blive aerosoliseret har også gjort den til en biovåbenkandidat, øge behovet for at forstå sygdommen og udvikle effektive behandlinger.
I en ny undersøgelse, forskere ved Biodesign Center for Applied Structural Discovery undersøger et nøglemembranprotein, der er ansvarligt for bakteriens fantastiske evne til at inficere kroppen og forårsage sygdom. Denne virulensfaktor, kendt som Flpp3, undersøges i hidtil uset detaljer ved hjælp af en røntgenfri elektronlaser eller XFEL, en massiv og kraftfuld røntgenaccelerator placeret ved SLAC National Accelerator Laboratory, Stanford.
XFEL-teknologien bruger strålende og ekstremt korte røntgenstråler til at sondere krystalliserede prøver af Flpp3, afslører proteinets detaljerede struktur som aldrig før. Ved at sammenligne den strukturelle information indsamlet af XFEL-eksperimenter med tidligere strukturel analyse ved hjælp af NMR, forskere har udviklet en mere komplet model af Flpp3's detaljerede form. (Tidligere undersøgelser har vist, at når et gen, der koder for Flpp3, er deaktiveret, virkningerne af F. tularensis-patogenet er væsentligt formindsket.)
Forskere håber i sidste ende at bruge denne information til at udvikle målrettede lægemidler, der er i stand til at deaktivere proteinets virulensegenskaber og beskytte mod tularæmi. Fremskridtene i forståelsen kan også hjælpe videnskabsmænd med at udvikle en effektiv vaccine mod sygdommen i fremtiden. I øjeblikket, der findes kun levende svækkede vacciner mod tularæmi, og risiko for infektion og utilstrækkelig immunitet forbundet med denne tilgang har udelukket brug af sådanne vacciner i USA.
Biodesignforsker Dr. James Zook sammen med professorerne Petra Fromme og Abhishek Singharoy ved Biodesign Center for Applied Structural Discovery ledede den nye undersøgelse. Han får selskab af internationale kolleger, herunder forskere fra DESY, SLAC, AstraZeneca, European Molecular Biology Laboratory i Grenoble, Frankrig, blandt andre.
Petra Fromme, direktør for Center for Applied Structural Discovery forklarer betydningen af resultaterne:"Denne undersøgelse kombinerer, for første gang, state of the art XFEL-teknikker med NMR og molekylær modellering for at optrevle det store konformationelle rum i Flpp3. Undersøgelsen afslører forskellige konformationer af dette vigtige protein for bakteriens virulens i XFEL- og NMR -strukturen og viser derved den meget dynamiske karakter af Flpp3. Denne undersøgelse er så spændende, da den viser, at meget forskellige konformationer eksisterer side om side og omdannes til hinanden under fysiologiske forhold."
Visualisering af virulens
Ved hjælp af detaljerede strukturelle data fra NMR og ny XFEL -analyse af tularæmi -virulensfaktoren, forskerne identificerede en potentiel hæmmer af Flpp3. Denne information blev opnået fra tilgængelige virtuelle biblioteker indeholdende strukturer af lægemiddelfragmenter. Næste, en fysikbaseret modelleringsmetode, kendt som molekylær dynamik (MD), leverede detaljerede oplysninger om udsving og konformationsændringer af atomer og molekyler i det virulensbundne protein hjælper forskere med at få en mere præcis læsning af Flpp3s struktur og adfærd.
"Dette arbejde giver flere atomare opløsningsstrukturer af en vigtig virulensfaktor fra bakterien, der forårsager tularæmi, " ifølge biodesignforsker Dr.Debra Hansen, medforfatter til det nye studie. De identificerede proteinkonfigurationer vil hjælpe forskere med at forfølge strukturbaseret design af lægemidler, der kan være effektive mod den undvigende sygdom, gennem målretning og inhibering af Flpp3.
Som medforfatter og biodesignforsker Dr. Abhishek Singharoy forklarer, undersøgelsen er bemærkelsesværdig for at være blandt de første undersøgelser af proteinkonformationel fleksibilitet opdaget med seriel femtosekund røntgenkrystallografi og NMR og bekræftet ved hjælp af molekylær dynamik (MD) simuleringer.
Gruppens fund fremgår af det aktuelle nummer af Cell Press journal Struktur .
Vedvarende trussel
Tularæmi, også kendt som kaninfeber, er en sjælden infektionssygdom, angriber typisk øjnene, hud, lymfeknuder og lunger efter infektion med bakterien F. tularensis. Sygdommen er endemisk i Nordamerika såvel som i mange dele af Europa og Asien, selvom tilfælde af tulariæmi er ualmindeligt, og fuldstændige udbrud har tendens til at være begrænset til regioner med dårlige sanitære forhold og utilgængelighed til moderne sundhedspleje.
Tularæmi rammer primært pattedyr, især gnavere, kaniner og harer, selvom det nogle gange også inficerer fugle, får, og husdyr, inklusive hunde, katte og hamstere.
Sygdommen kan spredes til mennesker gennem insektbid og direkte eksponering for et inficeret dyr. Sygdommen er ekstremt smitsom. Kun 10 bakterieceller kan være dødelige, og en enkelt bakterie kan være tilstrækkelig til at forårsage infektion. Organismen kan leve i uger i jorden, vand og døde dyr.
Tularæmi kan behandles effektivt, hvis det opdages tidligt, selvom behandlingsregimet kan være langvarigt og komplekst. De fleste inficerede med F. tularensis viser symptomer inden for tre til fem dage, selvom det kan tage så lang tid som to uger.
Sygdommen findes i en række forskellige former med forskellige symptomer, afhængig af hvordan og hvor bakterierne kommer ind i kroppen. Disse omfatter ulceroglandulær tularæmi, den mest almindelige form, som producerer sår i huden på infektionsstedet, hævede og smertefulde lymfekirtler, feber, kuldegysninger, hovedpine og udmattelse.
Andre former omfatter kirtel, oculoglandular, orofaryngeal, pneumonisk, og tyfus tularæmi. Hvis det ikke behandles, en række alvorlige komplikationer fra sygdommen kan opstå, inklusive meningitis, betændelse i lungerne, irritation omkring hjertet og infektion i knogler.
Krystal metode
I den aktuelle undersøgelse, en teknik kendt som seriel femtosekund røntgenkrystallografi bruges til at sondere strukturen af Flpp3-proteinet. Her, korte og strålende røntgenudbrud, omtrent en milliard gange lysere end konventionelle røntgenstråler, slå en stråle af krystaller "flyvende" gennem røntgenstrålen. Den intense røntgeneksplosion ødelægger krystallerne, men før du gør det, skaber et diffraktionsmønster på en skærm. Røntgenimpulserne er ultrakorte, varer kun 40 femtosekunder, at de overskrider røntgenskader, gør det muligt at indsamle data ved stuetemperatur under næsten fysiologiske forhold. (1 fs =10 -15 sekunder eller en kvadrilliontedel af et sekund.)
Samling af mange af disse røntgenbilleder ved hjælp af computere tillader samling af en detaljeret, 3-D struktur af proteinet under undersøgelse. Denne såkaldte diffraktion før destruktion-metoden blev først udviklet af Henry Chapman ved Deutsches Elektronen-Synchrotron (DESY) med teamet på ASU under ledelse af John Spence og Petra Fromme og deres samarbejdspartnere.
Forskerne kombinerede de nye XFEL -strukturdata med deres tidligere NMR -undersøgelser af Flpp3, observere to forskellige tilstande af proteinet. MD-simuleringerne afslørede en indre kavitetsstruktur, der er forbigående, tyder på, at Flpp3 gennemgår en subtil konformationsændring.
Tilgangen åbner døren til målrettet lægemiddeludvikling, der sigter mod at reducere dødeligheden af tulariæmi og viser kraften i kombinerede teknologier til at låse op for detaljerne i proteinstruktur og dynamik.
 Varme artikler
Varme artikler
-
 Forskere genopliver ældgamle proteiner for at give spor om molekylær innovationBillede af ID23-1, en af de ESRF strukturelle biologi beamlines, hvor eksperimenterne blev udført. Kredit:ESRF/P. Jayet Enzymaktivitet bestemmes af strukturen af en bestemt region af et protei
Forskere genopliver ældgamle proteiner for at give spor om molekylær innovationBillede af ID23-1, en af de ESRF strukturelle biologi beamlines, hvor eksperimenterne blev udført. Kredit:ESRF/P. Jayet Enzymaktivitet bestemmes af strukturen af en bestemt region af et protei -
 Hvordan man gør vandet klart efter tilsætning af madfarveBørn elsker at se videnskabseksperimenter, der trodser deres virkelighedskoncept. En lille mængde blegemiddel, der leveres sammen med en øjendråber, ændrer farven på farvet vand, hvilket får farven
Hvordan man gør vandet klart efter tilsætning af madfarveBørn elsker at se videnskabseksperimenter, der trodser deres virkelighedskoncept. En lille mængde blegemiddel, der leveres sammen med en øjendråber, ændrer farven på farvet vand, hvilket får farven -
 Bæredygtigt byggeri ved hjælp af miljøvenlig betonForskellige former testet for den smeltbare metalfiber. Kredit:Tokyo Institute of Technology Den 18. februar Lektor Masatoshi Kondo (Laboratory for Advanced Nuclear Energy, Institut for Innovativ
Bæredygtigt byggeri ved hjælp af miljøvenlig betonForskellige former testet for den smeltbare metalfiber. Kredit:Tokyo Institute of Technology Den 18. februar Lektor Masatoshi Kondo (Laboratory for Advanced Nuclear Energy, Institut for Innovativ -
 Sådan finder du antallet af repræsentative partikler i hvert stofMange kemistuderende skal beregne antallet af repræsentative partikler i et stof. Et stof har en bestemt kemisk sammensætning med en tilsvarende kemisk formel. Repræsentative partikler kan være atomer
Sådan finder du antallet af repræsentative partikler i hvert stofMange kemistuderende skal beregne antallet af repræsentative partikler i et stof. Et stof har en bestemt kemisk sammensætning med en tilsvarende kemisk formel. Repræsentative partikler kan være atomer
- Kina navngiver Mars rover for traditionel ildgud
- Nye data afslører betydningen af Perths superstorm
- Ledetråde om, hvordan jord kan reagere på fundet af klimaændringer
- Hvorfor flere hedebølger bringer vores sundhed og arbejdsevne i fare
- Undersøgelse har til formål at forbedre indfangning af vindkraft til energiproduktion
- Forskere antyder, at Lillefod er en helt ny art af tidlige mennesker


