Et nyt opløsningsmiddelsystem:Hydrotermalt smeltet salt
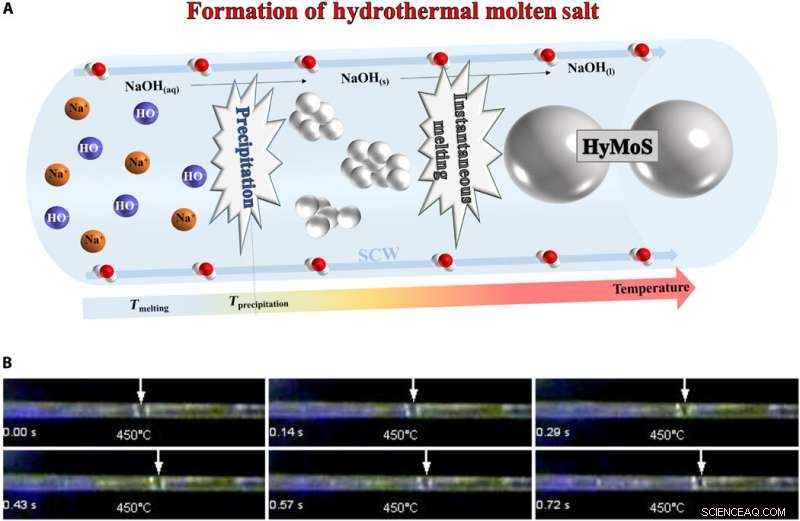
Dannelse af HyMoS. (A) Skema for dannelsen af HyMoS i SCW, med eksemplet på NaOH. (B) Montagebillede fra film S1 (nedenfor), der viser den direkte observation og bevægelse af en smeltet NaOH -dråbe i en safirkapillær ved 25 MPa og 450 ° C. Fotokredit:Thomas Voisin, ICMCB. Kredit:Science Advances, doi:10.1126/sciadv.aaz7770
I en ny rapport om Videnskab fremskridt , T. Voisin og et forskerhold i National Scientific Research Center og Institute of Technology and Energy Management i Frankrig, foreslået et nyt opløsningsmiddelsystem. Det hydrotermiske smeltede salt (HyMoS) system, består af et smeltet salt i vand under tryk og er i stand til at ændre opløseligheden af uorganiske stoffer i superkritisk vand. Forskerne brugte natriumhydroxid (NaOH); salt ved lav smeltetemperatur, og viste evnen til at udfælde den ved en temperatur over dens smeltepunkt, for øjeblikkeligt at danne HyMoS. Det smeltede salt kunne derefter opløse en stor mængde uorganisk salt, herunder natriumsulfat (Na 2 SÅ 4 ). Opløsningsmiddelsystemet åbner en ny vej inden for forskellige områder, herunder materialesyntese, biomasseomdannelse, grøn kemi, genbrug, katalyse og bæredygtig fremstilling. Arbejdet giver muligheder ud over hydrotermisk dynamik til at undersøge kemi og indsigt i nyskabende saltudfældning.
Superkritisk vand er ofte kendt som et "magisk" opløsningsmiddel, på grund af dets evne til at opløse olie. Denne ejendom har udvidet de potentielle anvendelser for SCW i materialesyntese, genbrug eller omdannelse af biomasse. Imidlertid, efterhånden som polariteten af SCW nedbrydes, opløseligheden af de uorganiske forbindelser falder. Udfordringen kan løses ved at identificere gode co-solvent-kandidater med stor opløsningskapacitet for uorganiske forbindelser sammen med høj termisk stabilitet, at overvinde grænserne for SCW. Smeltede salte er en attraktiv mulighed på grund af deres høje densitet og vigtige opløsningskapacitet. Smeltede salte er meget forskellige og bruges rigeligt i årtier som nitratsalte, carbonater, hydroxider eller eutektiske blandinger til opløsning af uorganiske materialer. I dette arbejde, Voisin et al. foreslået at generere smeltet salt inden for SCW for at overvinde grænserne for SCW alene. De sammensatte det hydrotermiske smeltede salt (HyMoS) med et salt af interesse sammen med SCW, til hydrotermiske applikationer ved høje temperaturer.

Video af observation af en NaOH-H2O-blanding ved 25 MPa og 450 ° C i et safirrør. Videoen viser bevægelsen af den smeltede NaOH -dråbe inde i kapillæren i vand. Kredit:Science Advances, doi:10.1126/sciadv.aaz7770
Til HyMoS -dannelse, holdet injicerede en homogen elektrolytopløsning af vand/salt under tryk og opvarmede det, så saltet kunne udfælde. Da nedbørstemperaturen var højere end smeltetemperaturen, fusion af saltet fulgte øjeblikkeligt nedbør, at danne HyMoS. Forskerne bemærkede udviklingen og bevægelsen af en smeltet NaOH -dråbe i SCW inden for en safirkapillær. Da de afkølede systemet, de kunne genvinde den oprindelige homogene elektrolytopløsning af vand/salt, da mekanismen var fuldstændig reversibel. Voisin et al. valgte NaOH -saltet for dets høje termiske stabilitet og lave smeltetemperatur (318 0 C) og høj kapacitet til at opløse uorganiske salte.
Teamet brugte en eksperimentel opsætning, beskrevet andetsteds, at måle opløselighedsværdierne og studere natriumhydroxidets adfærd i SCW. De undersøgte forskellen i densitet og viskositet mellem de to komponenter for at måle opløseligheden af forbindelsen under SCW -betingelser. To-trins mekanismen for fast nedbør var hurtig, og der blev ikke observeret faste partikler i safir-kapillærudstyret udstyret med et konventionelt ladningskoblet apparatkamera med 50 billeder i sekundet. Resultaterne viste muligheden for at skabe et tæt co-solvent, der flyder sammen med SCW. Holdet fokuserede derefter på NaOHs kapacitet til at opløse andre uorganiske salte under SCW -betingelser.
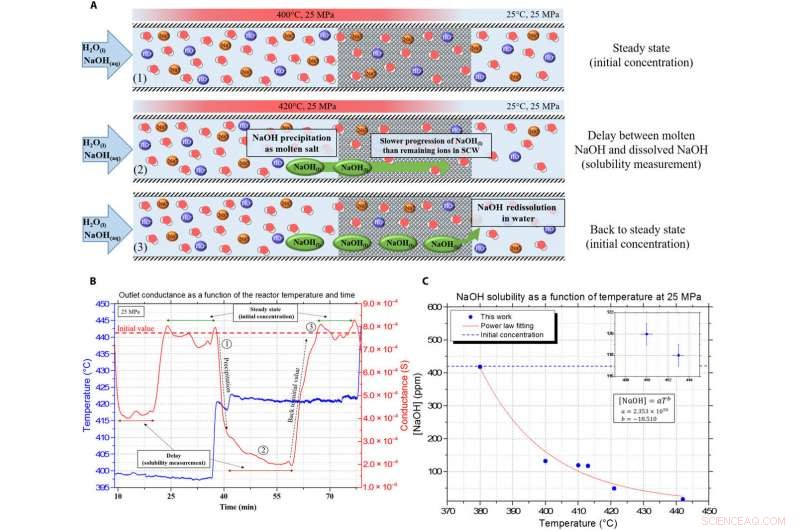
Præsentation af de kontinuerlige konduktivitetsdata og forsinkelsen, bruges til at måle opløseligheden i smeltet NaOH. (A) Illustration af måleprincippet ved hjælp af forsinkelsesanalyse på grund af viskositeten og tæthedsforskellene i de porøse medier mellem NaOH og SCW. (B) Eksempel på den kontinuerlige måling opnået med forsinkelsesprincippet, med den blå kurve som temperaturen inde i reaktoren og den røde linje er konduktansmåling ved udløbet (korrigeret fra tidsforsinkelsen). (C) resulterende NaOH -opløselighedskurve i SCW ved 25 MPa. Kredit:Science Advances, doi:10.1126/sciadv.aaz7770
For at fremhæve kapaciteten for NaOH-baseret HyMoS til at opløse et fast salt i SCW, holdet foreslog en anden eksperimentel protokol. Under forsøget, de injicerede først en vandig opløsning af det uorganiske salt natriumsulfat (Na 2 SÅ 4 ) i systemet ved en given temperatur for at deponere det faste salt på reaktantvæggen. Da Voisin et al. kendte opløseligheden af Na 2 SÅ 4, de kontrollerede, om der forekom nedbør i systemet under kontinuerlige målinger af konduktivitet. Forskerne beregnede koncentrationen af natriumsulfat i natriumhydroxidopløsningen. Selvom den stigende temperatur i opsætningen havde ringe indflydelse på det uorganiske salt natriumsulfat, den indledende koncentration af det smeltede saltnatriumhydroxid havde en stor indflydelse på dets opløsningshastighed. Ganske logisk derfor, da koncentrationen af natriumhydroxid steg, dens tilsvarende smeltede fase steg også i opsætningen, forårsager højere opløsningshastigheder af uorganiske salte, der er aflejret i reaktoren for at sikre kontinuerlig strømning.
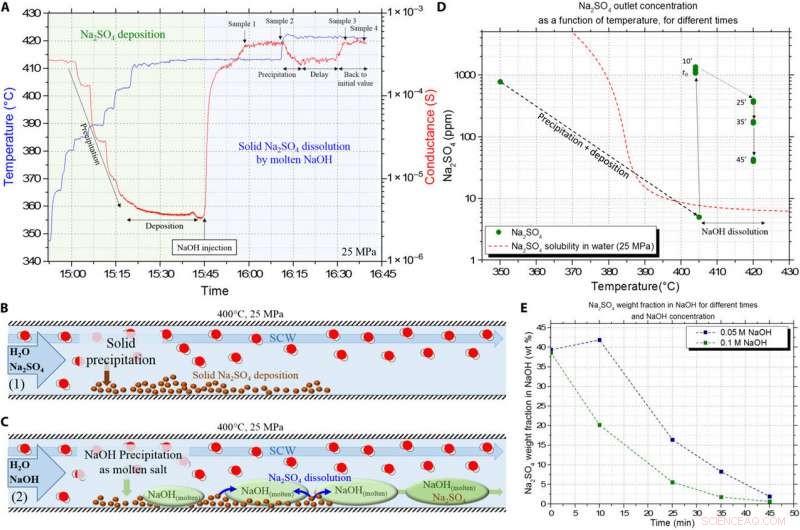
Validering af opløsningen af det afsatte Na2SO4 -faste salt ved hjælp af NaOH HyMoS i SCW i kontinuerlig strømning. (A) Rå konduktans (i rødt) og temperatur (i blå) signaler opnået fra den eksperimentelle opsætning, viser de forskellige trin i protokollen. Grøn zone repræsenterer Na2SO4 nedbør og saltaflejringstrin i reaktoren, og blå zone repræsenterer injektion af NaOH -opløsning for at opløse det afsatte salt. (B) Skema, der illustrerer det første trin i forsøget, der består i saltaflejring ved nedbør. (C) Skema, der illustrerer det andet trin i forsøget, med udfældning/smeltning af NaOH og opløsning af det tidligere afsatte Na2SO4. (D) Na2SO4 ICP -koncentration resultater i henhold til temperaturen, til forskellige tidspunkter under opløsningen ved NaOH. Sammenligning mellem foranstaltningerne og den normale opløselighed af Na2SO4 i SCW. (E) Evolution af Na2SO4 -massefraktionen i NaOH -smeltet fase med tiden, til to forskellige NaOH -foderkoncentrationer. Kredit:Science Advances, doi:10.1126/sciadv.aaz7770
På denne måde, T. Voisin og kolleger observerede smeltet salt i SCW for at løse de eksisterende udfordringer med superkritisk væskebaserede teknologier. Ved anvendelse af et stabilt smeltet hydroxid -salt, såsom natriumhydroxid, frembragte de et in situ -opløsningsmiddel for at opløse en stor mængde af det faste natriumsulfat -salt. Forskerne demonstrerede den første anvendelse af HyMoS og omgåede saltaflejring og obstruktion i reaktorerne for at udvikle kontinuerlige strømningsprocesser. Teknikken er omkostningseffektiv, da basiske salte, såsom NaOH, der blev brugt i eksperimenterne, er relativt billige materialer, sammenlignet med komplekse ioniske væsker. Kapaciteten til at generere et tæt opløsningsmiddel med et enkelt og billigt system har også indflydelse på hydrotermiske systemer. Smeltede salte er, imidlertid, begrænset i forhold til bearbejdelighed for kontinuerlige systemer på grund af den høje temperatur og høje viskositet, der kræves i batchsystemer. Det difasiske HyMoS -system består af SCW og et smeltet salt, og opsætningen kan udforskes som en ny type hydrotermisk vand/saltemulsion for effektivt at opløse en række forskellige salte.
© 2020 Science X Network
 Varme artikler
Varme artikler
-
 Eksperimenter med bifluoridioner viser tegn på hybridbindingerHydrogenbindinger. (A) Typer af hydrogenbindinger afhængigt af donor-acceptor afstand. Potentialer for protonbevægelse vises sammen med de tre første kvantenniveauer og de tilhørende laveste energiove
Eksperimenter med bifluoridioner viser tegn på hybridbindingerHydrogenbindinger. (A) Typer af hydrogenbindinger afhængigt af donor-acceptor afstand. Potentialer for protonbevægelse vises sammen med de tre første kvantenniveauer og de tilhørende laveste energiove -
 Sådan laver du et skoleprojekt Battlefield DisplayLav et slagmarkskærm til skole, der viser landets geografi samt militærbevægelserne fra soldaterne. Dette projekt kan udfyldes med elementer fundet i de fleste boliger. Hvad der ikke er tilgængeligt h
Sådan laver du et skoleprojekt Battlefield DisplayLav et slagmarkskærm til skole, der viser landets geografi samt militærbevægelserne fra soldaterne. Dette projekt kan udfyldes med elementer fundet i de fleste boliger. Hvad der ikke er tilgængeligt h -
 Biologisk nedbrydelig plast fra palmeolieaffaldKredit:CC0 Public Domain En bionedbrydelig film lavet af affald fra palmeolieindustrien kunne bruges til fødevareemballage Plastforurening er et presserende miljøproblem i det enogtyvende århundr
Biologisk nedbrydelig plast fra palmeolieaffaldKredit:CC0 Public Domain En bionedbrydelig film lavet af affald fra palmeolieindustrien kunne bruges til fødevareemballage Plastforurening er et presserende miljøproblem i det enogtyvende århundr -
 Membran kan bedre behandle spildevand, genvinde værdifulde ressourcerForskere foreslår, at nuværende afsaltningsprocesser og fremtidige hybride bruger en blokpolymermembran til at behandle ukonventionelle vandkilder. Kredit:University of Notre Dame billede/Yizhou Zhang
Membran kan bedre behandle spildevand, genvinde værdifulde ressourcerForskere foreslår, at nuværende afsaltningsprocesser og fremtidige hybride bruger en blokpolymermembran til at behandle ukonventionelle vandkilder. Kredit:University of Notre Dame billede/Yizhou Zhang
- MIT kæmper med tidlige lederes holdning til indianere
- Her er grunden til, at eleverne ikke reviderer, hvad de skriver – og hvorfor de burde
- Naturkatastrofer forårsaget af pladetektonik
- Bioinspireret materiale efterligner farveændringer i levende organismer
- Sådan Breed Mosquito Fish
- Ny Facebook AI-applikation kan fjerne blinke dine øjne på et billede


