Syntetisk antibiotikum, der kan tilpasses, udmanøvrerer resistente bakterier
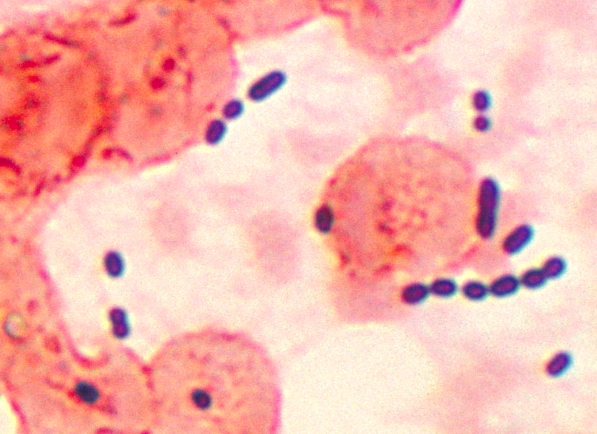
Dette mikrofotografi afslører cocci-formede Enterococcus sp. bakterier taget fra en lungebetændelsespatient. Enterococcus sp. er en almindelig, gram-positiv bakterie, der normalt kan findes i tarm og kvindelige kønsorganer. Disse bakterier kan spredes ved fækal-oral transmission, kontakt med inficerede kropsvæsker eller kontakt med kontaminerede overflader. Kredit:CDC/public domain
Antibiotikaresistens er en af verdens mest påtrængende folkesundhedstrusler. Alene i USA titusindvis af dødsfald skyldes hvert år lægemiddelresistente stammer af almindelige bakterier som Staphylococcus aureus og Enterococcus faecium, som kan forårsage praktisk talt ubehandlede hospitalserhvervede infektioner. Farligt få nye klasser af antibiotika bliver udviklet til at bekæmpe infektioner, der er blevet resistente over for traditionelle behandlinger, og det kan tage årtier at bringe nye lægemidler på markedet.
Forskere ved UC San Francisco tackler antibiotikaresistens ved hjælp af en anden tilgang:redesign af eksisterende antibiotikamolekyler for at undgå en bakteries resistensmekanismer. Ved at udtænke et sæt molekylære LEGO-stykker, der kan ændres og sættes sammen for at danne større molekyler, forskerne har skabt, hvad de håber er den første af mange "genopbygninger" af lægemidler, der var blevet henlagt på grund af antibiotikaresistens. Forskningen blev offentliggjort 23. september, 2020, i Natur.
"Målet er at genoplive klasser af lægemidler, der ikke har været i stand til at opnå deres fulde potentiale, især dem, der allerede har vist sig at være sikre hos mennesker, " sagde Ian Seiple, Ph.D., en adjunkt ved UCSF School of Pharmacy's Department of Pharmaceutical Chemistry og Cardiovascular Research Institute (CVRI), og hovedforfatter på papiret. "Hvis vi kan gøre det, det eliminerer behovet for konstant at komme med nye klasser af lægemidler, der kan overgå resistente bakterier. Redesign af eksisterende lægemidler kan være et vigtigt værktøj i denne indsats."
I arbejde beskrevet i det nye Natur papir, Seiple og hans samarbejdspartner James Fraser, Ph.D. en professor ved School of Pharmacy's Department of Bioengineering and Therapeutic Sciences i UCSF School of Pharmacy, har demonstreret denne tilgang med en klasse antibiotika kaldet streptograminer. Indtil for nylig, streptograminer var meget effektive mod S. aureus-infektioner, indtil bakterierne udviklede en smart modstandsmekanisme.
Streptograminer deaktiverer bakterier ved at dæmpe værkerne i det bakterielle ribosom, gør det umuligt for bakterierne at lave proteiner. Men bakterier, der er resistente over for streptograminer, producerer proteiner kaldet virginiamycinacetyltransferaser (Vats), som genkender disse antibiotika, når de kommer ind i bakteriecellen. Vatterne griber stoffet og deaktiverer det kemisk, før det kan binde sig til ribosomet, gør den ubrugelig.
Streptograminer, som de fleste andre antibiotika, er afledt af naturligt forekommende antibiotiske forbindelser produceret af andre organismer (normalt bakterier), som derefter justeres for at optimere deres ydeevne i den menneskelige krop. Seiple regnede med, at der også måtte være en måde at foretage yderligere ændringer på lægemiddelmolekylet, som ville gøre det muligt for det at unddrage sig indfangning af Vat-proteinerne.
Seiple satte sig for at bygge nye streptograminer fra bunden, i stedet for at ændre eksisterende strukturer. For at gøre byggeprocessen lettere, Qi Li, Ph.D., en postdoc-stipendiat i Seiple-laboratoriet og medførsteforfatter på papiret, skabt syv molekylære moduler, der kan justeres efter behov for at bygge et sæt variationer på streptogramin-molekylet.
"Dette system giver os mulighed for at manipulere byggestenene på måder, som ikke ville være mulige i naturen, " sagde Seiple. "Det giver os en effektiv vej til at omkonstruere disse molekyler fra bunden, og vi har meget mere råderum til at være kreative med, hvordan vi ændrer strukturerne."
Da Seiple og Li havde deres byggeklodser, det næste trin var at få et overblik på molekylært niveau af den involverede kemi for bedre at forstå, hvordan man modificerer og sammensætter disse molekylære LEGO'er.
For det, Seiple gik sammen med Fraser, der har specialiseret sig i at skabe visuelle modeller af biologiske molekyler.
"Mit laboratoriums bidrag var at sige, 'Nu hvor du har de syv stykker, hvilken af dem skal vi ændre og på hvilken måde?'" sagde Fraser, hvis arbejde på projektet blev støttet af den indledende Sanghvi-Agarwal Innovation Award.
For at få svar på det spørgsmål, Jenna Pellegrino, en kandidatstuderende i Fraser Group og medførsteforfatter på papiret, brugt to komplementære teknikker, kryo-elektronmikroskopi og røntgenkrystallografi, at skabe tredimensionelle billeder af lægemidlet ved næsten atomær opløsning, såvel som dets mål for det bakterielle ribosom, og dens nemesis, Vat-proteinet.
Ved at bruge modellerne, Li, Pellegrino, Seiple, og Fraser kunne se, hvilke dele af streptogramin-molekylet, der er afgørende for antibiotikaens funktion. Så var Li fri til at rode med lægemidlets ikke-essentielle områder for at finde modifikationer, der forhindrede Vats i at interagere med lægemidlet, mens det stadig tillod det at binde sig til dets ribosomale mål og deaktivere bakterien.
Holdet fandt ud af, at to af de syv byggeklodser syntes at tilbyde potentielt interessante steder til ændring. De lavede variationer af lægemidlet, der indeholdt tweaks i disse regioner og fandt ud af, at disse variationer havde aktivitet i snesevis af stammer af patogene bakterier. Forskerne testede også deres mest lovende kandidat mod streptogramin-resistente S. aureus i inficerede mus, og fandt ud af, at det var over 10 gange mere effektivt end andre streptogramin-antibiotika.
Seiple påpeger, at den viden opnået gennem disse samarbejdseksperimenter kan anvendes til at modificere mange andre antibiotika.
"Vi lærte om mekanismer, som andre klasser af antibiotika bruger til at binde til det samme mål, sagde han. Desuden vi etablerede en arbejdsgang for at bruge kemi til at overvinde resistens over for antibiotika, der ikke har nået deres potentiale."
Seiple vil fortsætte med at forfine disse syntetiske streptograminer og håber derefter at flytte arbejdet til den private sektor, hvor de ombyggede antibiotika kan videreudvikles og testes i forsøg på mennesker. Han og Fraser planlægger at fortsætte med at arbejde sammen om at genoplive andre antibiotika, der er blevet henlagt på grund af mikrobiel resistens, raffinering af et sæt værktøjer, der kan hjælpe forskere med at være et skridt foran i bakterieudviklingen.
"Det er et uendeligt våbenkapløb med bakterier, " sagde Fraser. "Men ved at studere de involverede strukturer - før modstand opstår - kan vi få en idé om, hvad de potentielle modstandsmekanismer vil være. Den indsigt vil være en guide til at lave antibiotika, som bakterier ikke kan modstå."
 Varme artikler
Varme artikler
-
 Blandingsregler for 3-D printknogleKredit:Pixabay/CC0 Public Domain Ved at kombinere syntetiske polymerer og naturlige materialer er det muligt at øge rækken af egenskaber, der kan fremstilles ved hjælp af 3-D-print af komponente
Blandingsregler for 3-D printknogleKredit:Pixabay/CC0 Public Domain Ved at kombinere syntetiske polymerer og naturlige materialer er det muligt at øge rækken af egenskaber, der kan fremstilles ved hjælp af 3-D-print af komponente -
 Et metallopeptid målretter og forstyrrer mitokondrielfunktionen i brystkræftstamcellerKredit:Wiley At dræbe maligne mitokondrier er en af de mest lovende fremgangsmåder i udviklingen af nye lægemidler mod kræft. Forskere fra Storbritannien har nu syntetiseret et kobberholdigt p
Et metallopeptid målretter og forstyrrer mitokondrielfunktionen i brystkræftstamcellerKredit:Wiley At dræbe maligne mitokondrier er en af de mest lovende fremgangsmåder i udviklingen af nye lægemidler mod kræft. Forskere fra Storbritannien har nu syntetiseret et kobberholdigt p -
 Teknik kan gøre det lettere at bruge mRNA til at behandle sygdom eller levere vacciner”Hvis vi vil være i stand til at levere mRNA, så har vi brug for en mekanisme til at være mere effektiv til det, fordi alt, hvad der har været brugt indtil nu, giver dig en meget lille brøkdel af, hva
Teknik kan gøre det lettere at bruge mRNA til at behandle sygdom eller levere vacciner”Hvis vi vil være i stand til at levere mRNA, så har vi brug for en mekanisme til at være mere effektiv til det, fordi alt, hvad der har været brugt indtil nu, giver dig en meget lille brøkdel af, hva -
 Samarbejde giver opdagelse af 12-sidede silicabureDoktorand Melik Turker, venstre, har en model af et dodekaeder i Ulrich Wiesners laboratorium. På billedet er også ph.d.-studerende Yunye Gong, centrum, holder en model af en burstruktur, og postdoc-f
Samarbejde giver opdagelse af 12-sidede silicabureDoktorand Melik Turker, venstre, har en model af et dodekaeder i Ulrich Wiesners laboratorium. På billedet er også ph.d.-studerende Yunye Gong, centrum, holder en model af en burstruktur, og postdoc-f
- Undersøgelse:Hospitalets sikkerhedsvagter udøver overdreven fysisk vold, kræver træning
- Step-by-Step Videnskabsprojekt, på hvilket Juice Cleans Pennies The Best
- Sådan konverteres pund pr. Kvadratfod til PSI
- Ny type magnetisme afsløret i et ikonisk materiale
- Hvilke episke rummissioner som Cassini lærer os om os selv
- En vejledning om videnskaben om at lave godt øl


