2 forskere vinder Nobels kemipris for genredigeringsværktøj

I denne 14. marts, 2016 filfoto Amerikansk biokemiker Jennifer A. Doudna, venstre, og den franske mikrobiolog Emmanuelle Charpentier, ret, udgør et foto i Frankfurt, Tyskland. Den franske videnskabsmand Emmanuelle Charpentier og amerikanske Jennifer A. Doudna har vundet Nobelprisen 2020 i kemi for at udvikle en metode til genomredigering sammenlignet med 'molekylsaks', der giver løfte om en dag at helbrede genetiske sygdomme. (Alexander Heinl/dpa via AP)
Nobelprisen i kemi gik til to forskere onsdag for et genredigeringsværktøj, der har revolutioneret videnskaben ved at give en måde at ændre DNA, livets kodeks - teknologi bruges allerede til at helbrede et væld af sygdomme og opdrætte bedre afgrøder og husdyr.
Emmanuelle Charpentier fra Frankrig og Jennifer A. Doudna fra USA vandt for at udvikle CRISPR-cas9, en meget enkel teknik til at skære et gen på et bestemt sted, tillader forskere at operere på fejl, der er årsagen til mange sygdomme.
"Der er enorm kraft i dette genetiske værktøj, "sagde Claes Gustafsson, formand for Nobelkomiteen for kemi.
Mere end 100 kliniske forsøg er i gang for at studere ved hjælp af CRISPR til behandling af sygdomme, og "mange er meget lovende, "ifølge Victor Dzau, formand for National Academy of Medicine.
"Mit største håb er, at det bruges til det gode, at afdække nye mysterier inden for biologi og gavne menneskeheden, "sagde Doudna, der er tilknyttet University of California, Berkeley, og betales af Howard Hughes Medical Institute, som også understøtter Associated Press 'Health and Science Department.
Det prisvindende arbejde har åbnet døren for nogle tornede etiske spørgsmål:Når redigering udføres efter fødslen, ændringerne er begrænset til den pågældende person. Forskere frygter, at CRISPR vil blive misbrugt til at lave "designerbabyer" ved at ændre æg, embryoner eller sædceller - ændringer, der kan videregives til kommende generationer.
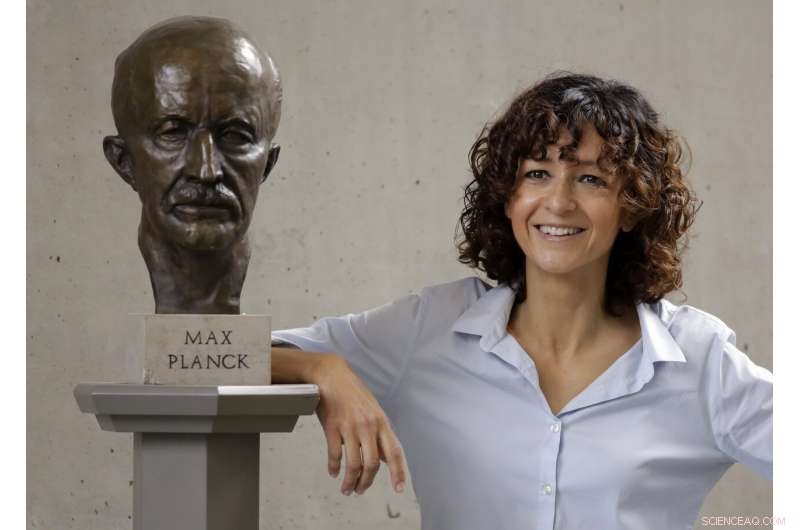
Den franske mikrobiolog Emmanuelle Charpentier poserer nær en statue af Max Planck i Berlin, Tyskland, Onsdag, 7. oktober kl. 2020. Den franske videnskabsmand Emmanuelle Charpentier og amerikanske Jennifer A. Doudna har vundet Nobelprisen 2020 i kemi for at udvikle en metode til genomredigering sammenlignet med 'molekylsaks', der giver løfte om en dag at helbrede genetiske sygdomme. (AP Photo/Markus Schreiber)
Meget af verden blev opmærksom på CRISPR i 2018, da den kinesiske videnskabsmand He Jiankui afslørede, at han havde været med til at lave verdens første genredigerede babyer, at forsøge at konstruere resistens over for infektion med AIDS -virussen. Hans arbejde blev fordømt som usikre menneskelige eksperimenter, og han er blevet dømt til fængsel i Kina.
I september, et internationalt ekspertpanel udsendte en rapport om, at det er for tidligt at prøve sådanne eksperimenter, fordi videnskaben ikke er avanceret nok til at sikre sikkerheden.
"At kunne selektivt redigere gener betyder, at du spiller Gud på en måde, "sagde American Chemical Society's præsident Luis Echegoyen, en kemiprofessor ved University of Texas El Paso.
Dr. George Daley, dekan ved Harvard Medical School, sagde:"Ny teknologi præsenterer ofte denne dikotomi - der er et enormt potentiale til gavn for mennesker, især til sygdomsbehandling, men også risikoen for forkert anvendelse. "

Den franske mikrobiolog Emmanuelle Charpentier taler med mediefolk i Berlin, Tyskland, Onsdag, 7. oktober kl. 2020. Den franske videnskabsmand Emmanuelle Charpentier og amerikanske Jennifer A. Doudna har vundet Nobelprisen 2020 i kemi for at udvikle en metode til genomredigering sammenlignet med 'molekylsaks', der giver løfte om en dag at helbrede genetiske sygdomme. (AP Photo/Markus Schreiber)
Imidlertid, forskere roste universelt det store potentiale, som genredigering har for patienter nu.
"Der er intet aspekt af biomedicinsk forskning, som ikke er blevet berørt af CRISPR, "som er blevet brugt til at konstruere bedre afgrøder og til at forsøge at helbrede menneskelige sygdomme, herunder seglcelle, HIV -infektion og nedarvede former for blindhed, sagde Dr. Kiran Musunuru, en genetikekspert ved University of Pennsylvania, der undersøger det for hjertesygdomme.
Doudna sagde, at CRISPR også har potentiale til at blive brugt til at konstruere anlæg til lagring af mere kulstof eller til at modstå ekstreme klimaforandringer, at give forskere en chance for at "tage fat på presserende problemer, menneskeheden står over for."
Det er fjerde gang i den 119-årige historie med præmierne, at en nobel i videnskaberne udelukkende blev givet til kvinder.
Charpentier, den 51-årige leder af Max Planck-enheden for patogenernes videnskab i Berlin, sagde, at mens hun først og fremmest betragter sig selv som en videnskabsmand, "det afspejler, at videnskaben bliver mere moderne og involverer flere kvindelige ledere."

I denne maj 19, 2015 filfoto Fransk mikrobiolog Emmanuelle Charpentier poserer til et foto i Brunswick, Tyskland. Den franske videnskabsmand Emmanuelle Charpentier og amerikanske Jennifer A. Doudna har vundet Nobelprisen 2020 i kemi for at udvikle en metode til genomredigering sammenlignet med 'molekylsaks', der giver løfte om en dag at helbrede genetiske sygdomme. (Peter Steffen/dpa via AP)
"Jeg håber, at det vil forblive og endda udvikle sig mere i denne retning, " hun sagde, tilføjer, at det er "mere besværligt at være kvinde i videnskab end at være mand inden for videnskab."
Tre gange har en kvinde selv vundet en nobel i videnskaberne; det er første gang, at et helt kvindeligt hold vandt en videnskabspris. I 1911, Marie Curie var den eneste modtager af kemiprisen, ligesom Dorothy Crowfoot Hodgkin i 1964. I 1983, Barbara McClintock vandt Nobel i medicin.
Den banebrydende forskning udført af Charpentier og Doudna blev offentliggjort i 2012, gør opdagelsen meget nylig sammenlignet med en masse anden nobelvindende forskning, som ofte først bliver hædret efter årtier er gået.
Dr. Francis Collins, der førte drevet til at kortlægge det menneskelige genom, sagde, at teknologien "har ændret alt" om, hvordan man griber sygdomme til med en genetisk årsag.

I denne 14. marts, 2016 filfoto Fransk mikrobiolog Emmanuelle Charpentier poserer til et foto i Frankfurt, Tyskland. Den franske videnskabsmand Emmanuelle Charpentier og amerikanske Jennifer A. Doudna har vundet Nobelprisen 2020 i kemi for at udvikle en metode til genomredigering sammenlignet med 'molekylsaks', der giver løfte om en dag at helbrede genetiske sygdomme. (Alexander Heinl/dpa via AP)
"Du kan trække en direkte linje fra succesen med det menneskelige genomprojekt til kraften i CRISPR-cas til at foretage ændringer i instruktionsbogen, "sagde Collins, direktør for U.S.National Institutes of Health, som hjalp med at finansiere Doudnas arbejde.
The Broad Institute, i fællesskab drevet af Harvard og MIT, har været i en domstolskamp med nobelvinderne om patenter på CRISPR -teknologi, og mange andre forskere udførte et vigtigt arbejde med det, men Doudna og Charpentier er blevet mest konsekvent hædret med præmier for at gøre det til et let brugbart værktøj.
Feng Zhang, den videnskabsmand, der er mest kendt for det arbejde, kommenterede ikke priserne, men Broad's direktør, Eric Lander, sendte tillykke på Twitter til vinderne. En anden bred genredigeringsforsker, David Liu, bemærkede på Twitter, at vindernes sædvanlige forskningsartikel i 2012 er blevet citeret mere end 9, 500 gange, eller cirka en gang hver otte time.
-

Denne tirsdag, 1. december kl. 2015 filkombination viser Emmanuelle Charpentier, venstre, og Jennifer Doudna, både tale på National Academy of Sciences internationale topmøde om sikkerhed og etik ved menneskelig genredigering, i Washington. Nobelprisen i kemi i 2020 er blevet tildelt Emmanuelle Charpentier og Jennifer Doudna "for udviklingen af en metode til genomredigering." Et panel ved det svenske videnskabsakademi i Stockholm offentliggjorde onsdagen den 7. oktober, 2020. (AP Photo/Susan Walsh, Fil)
-

I denne 14. marts, 2016 filfoto Amerikansk biokemiker Jennifer A. Doudna poserer til et foto i Frankfurt, Tyskland. Den franske videnskabsmand Emmanuelle Charpentier og amerikanske Jennifer A. Doudna har vundet Nobelprisen 2020 i kemi for at udvikle en metode til genomredigering sammenlignet med 'molekylsaks', der giver løfte om en dag at helbrede genetiske sygdomme. (Alexander Heinl/dpa via AP)
-

I denne 1. dec. 2015, fil foto, Jennifer Doudna, et universitet i Californien, Berkeley, medopfinder af CRISPR-genredigeringsværktøjet, som He Jiankui brugte, taler på National Academy of Sciences internationale topmøde om sikkerhed og etik ved menneskelig genredigering, i Washington. Nobelprisen i kemi i 2020 er blevet tildelt Emmanuelle Charpentier og Jennifer Doudna "for udviklingen af en metode til genomredigering." Et panel ved det svenske videnskabsakademi i Stockholm offentliggjorde onsdagen den 7. oktober, 2020. (AP Photo/Susan Walsh, Fil)
-

Professor Pernilla Wittung Stafshede, venstre, og Goran K. Hansson, Generalsekretær for Videnskabsakademiet, efter at have offentliggjort vinderne af Nobelprisen i kemi 2020 under en pressekonference på Royal Swedish Academy of Sciences, i Stockholm, Sverige, Onsdag den 7. oktober, 2020. Nobelprisen i kemi i 2020 er blevet tildelt Emmanuelle Charpentier, tilbage på skærmen, og Jennifer Doudna "til udvikling af en metode til genomredigering." (Henrik Montgomery/TT via AP)
Nobelen kommer med en guldmedalje og 10 millioner kroner (mere end $ 1,1 millioner), takket være et legat, der blev efterladt for mere end et århundrede siden af prisens skaber, Alfred Nobel, opfinderen af dynamit.
På mandag, Nobelen i medicin blev tildelt for opdagelsen af den lever-hærgende hepatitis C-virus. Tirsdagens pris i fysik hædrede gennembrud i forståelsen af sorte huller. Priserne i litteratur, fred og økonomi vil blive tildelt i de kommende dage.
Meddelelsen fra Nobelfonden:
Det Kongelige Svenske Videnskabsakademi har besluttet at tildele Nobelprisen i kemi 2020 til
Emmanuelle Charpentier
Max Planck -enhed for videnskab om patogener, Berlin, Tyskland
Jennifer A. Doudna
University of California, Berkeley, USA
"til udvikling af en metode til genomredigering"
Genetisk saks:et værktøj til omskrivning af livskoden
Emmanuelle Charpentier og Jennifer A. Doudna har opdaget et af genteknologiens skarpeste værktøjer:den genetiske sakse CRISPR/Cas9. Ved hjælp af disse, forskere kan ændre dyrenes DNA, planter og mikroorganismer med ekstrem høj præcision. Denne teknologi har haft en revolutionerende indvirkning på biovidenskaben, bidrager til nye kræftbehandlinger og kan få drømmen om at helbrede arvelige sygdomme til virkelighed.
Forskere skal ændre gener i celler, hvis de skal finde ud af om livets indre virke. Dette plejede at være tidskrævende, vanskeligt og til tider umuligt arbejde. Brug af den genetiske sakse CRISPR/Cas9, det er nu muligt at ændre livskoden i løbet af et par uger.
"Der er enorm kraft i dette genetiske værktøj, som påvirker os alle. Det har ikke kun revolutioneret grundvidenskaben, men også resulteret i innovative afgrøder og vil føre til banebrydende nye medicinske behandlinger, "siger Claes Gustafsson, formand for Nobelkomiteen for kemi.
Som så ofte inden for videnskab, opdagelsen af disse genetiske saks var uventet. Under Emmanuelle Charpentiers undersøgelser af Streptococcus pyogenes, en af de bakterier, der forårsager størst skade på menneskeheden, hun opdagede et tidligere ukendt molekyle, tracrRNA. Hendes arbejde viste, at tracrRNA er en del af bakteriernes gamle immunsystem, CRISPR/Cas, der afvæbner vira ved at spalte deres DNA.
Charpentier offentliggjorde sin opdagelse i 2011. Samme år, hun indledte et samarbejde med Jennifer Doudna, en erfaren biokemiker med stort kendskab til RNA. Sammen, det lykkedes dem at genskabe bakteriens genetiske saks i et reagensglas og forenkle saksenes molekylære komponenter, så de var lettere at bruge.
I et epokegørende eksperiment, de omprogrammerede derefter den genetiske sakse. I deres naturlige form, saksen genkender DNA fra vira, men Charpentier og Doudna beviste, at de kunne kontrolleres, så de kan skære ethvert DNA -molekyle på et forudbestemt sted. Hvor DNA'et skæres, er det let at omskrive livskoden.
Siden Charpentier og Doudna opdagede den genetiske sakse CRISPR/Cas9 i 2012, er deres anvendelse eksploderet. Dette værktøj har bidraget til mange vigtige opdagelser inden for grundforskning, og planteforskere har været i stand til at udvikle afgrøder, der tåler skimmelsvamp, skadedyr og tørke. I medicin, kliniske forsøg med nye kræftbehandlinger er i gang, og drømmen om at kunne helbrede arvelige sygdomme er ved at gå i opfyldelse. Disse genetiske saks har taget biovidenskaben ind i en ny epoke og, på mange måder, bringer den største fordel for menneskeheden.
****************************
En af videnskabens attraktioner er, at den er uforudsigelig - du kan aldrig på forhånd vide, hvor en idé eller et spørgsmål kan føre hen. Nogle gange vil et nysgerrigt sind møde en blindgyde, nogle gange vil den støde på en tornede labyrint, der tager år at navigere. Men, Nu og igen, hun indser, at hun er den første person nogensinde til at se på en horisont med utallige muligheder.
Genredaktøren kaldet CRISPR-Cas9 er en sådan uventet opdagelse med betagende potentiale. Da Emmanuelle Charpentier og Jennifer Doudna begyndte at undersøge immunsystemet for en Streptococcus -bakterie, en idé var, at de måske kunne udvikle en ny form for antibiotika. I stedet, de opdagede et molekylært værktøj, der kan bruges til at lave præcise snit i genetisk materiale, gør det muligt let at ændre livskoden.
Et kraftfuldt værktøj, der påvirker alle
Blot otte år efter deres opdagelse, disse genetiske saks har omdannet biovidenskaben. Biokemikere og cellebiologer kan nu let undersøge forskellige generers funktioner og deres mulige rolle i udviklingen af sygdom. I planteavl, forskere kan give planter specifikke egenskaber, såsom evnen til at modstå tørke i et varmere klima. I medicin, denne genredaktør bidrager til nye kræftbehandlinger og de første undersøgelser, der forsøger at helbrede arvelige sygdomme.
Der er næsten endeløse eksempler på, hvordan CRISPR-Cas9 kunne bruges, som også omfatter uetiske applikationer. Som med al kraftfuld teknologi, disse genetiske saks skal reguleres. Mere om det senere.
I 2011, hverken Emmanuelle Charpentier eller Jennifer Doudna anede, at deres første møde, på en café i Puerto Rico, var et livsforandrende møde. Vi starter med at præsentere Charpentier, der oprindeligt foreslog deres samarbejde.
Charpentier er fascineret af patogene bakterier
Nogle mennesker har kaldt hende drevet, opmærksom og grundig. Andre siger, at Emmanuelle Charpentier altid leder efter det uventede. Hende selv, hun citerer Louis Pasteur, "Chance favoriserer det forberedte sind". Trangen til at gøre nye opdagelser og ønsket om at være fri og uafhængig har styret hendes vej. Herunder hendes doktorgradsstudier ved Institut Pasteur i Paris, hun har boet i fem forskellige lande, syv forskellige byer og arbejdede på ti forskellige institutioner.
Hendes omgivelser og tilgange har ændret sig, men størstedelen af hendes forskning har en fællesnævner:patogene bakterier. Hvorfor er de så aggressive? Hvordan udvikler de deres resistens over for antibiotika? Og er det muligt at finde nye behandlinger, der kan stoppe deres fremskridt?
I 2002, da Emmanuelle Charpentier startede sin egen forskergruppe ved universitetet i Wien, hun fokuserede på en af de bakterier, der forårsager den største skade på menneskeheden:Streptococcus pyogenes. Hvert år, det inficerer millioner af mennesker, forårsager ofte let behandlingsbare infektioner såsom tonsillitis og impetigo. Imidlertid, det kan også forårsage livstruende sepsis og nedbryde det bløde væv i kroppen, giver det et ry som en 'kødspiser'.
For bedre at forstå S. pyogenes, Charpentier begyndte med grundigt at undersøge, hvordan denne bakteries gener reguleres. Denne beslutning var det første skridt på vejen til opdagelsen af den genetiske sakse - men inden vi går videre ad den vej, vi finder ud af mere om Jennifer Doudna. Fordi mens Charpentier foretager detaljerede undersøgelser af S. pyogenes, Doudna hører - for første gang - en forkortelse, som hun synes lyder skarpere.
Videnskab - lige så meget eventyr som en detektivhistorie
Selv som barn, der voksede op på Hawaii, Jennifer Doudna havde en stærk trang til at vide ting. En dag, hendes far lagde James Watsons bog The Double Helix på hendes seng. Denne detektivstil om hvordan James Watson og Francis Crick løste strukturen af DNA-molekylet lignede intet, hun havde læst i sine skolebøger. Hun blev betaget af den videnskabelige proces og indså, at videnskab er mere end bare fakta.
Imidlertid, da hun begyndte at løse videnskabelige mysterier, hendes opmærksomhed var ikke på DNA, men på dets molekylære søskende:RNA. I 2006 - da vi møder hende - leder hun en forskergruppe ved University of California, Berkeley, og har to årtiers erfaring med at arbejde med RNA. Hun har et ry som en succesrig forsker med en næse til banebrydende projekter, og er for nylig gået ind på et spændende nyt felt:RNA -interferens.
I mange år, forskere havde troet, at de forstod RNA's grundlæggende funktion, men de opdagede pludselig masser af små RNA -molekyler, der hjælper med at regulere genaktivitet i celler. Jennifer Doudnas engagement i RNA -interferens er årsagen til, at i 2006, hun får et telefonopkald fra en kollega i en anden afdeling.
Bakterier bærer et gammelt immunsystem
Hendes kollega, hvem er mikrobiolog, fortæller Doudna om en ny opdagelse:når forskere sammenligner genetisk materiale fra vidt forskellige bakterier, samt archaea (en type mikroorganisme), de finder gentagne DNA -sekvenser, der er overraskende godt bevaret. Den samme kode vises igen og igen, men mellem gentagelserne er der unikke sekvenser, der adskiller sig. Det er som om det samme ord gentages mellem hver unik sætning i en bog.
Disse arrays af gentagne sekvenser kaldes klyngede regelmæssigt mellemrum korte palindromiske gentagelser, forkortet som CRISPR. Det interessante er, at det unikke, ikke-gentagne sekvenser i CRISPR ser ud til at matche den genetiske kode for forskellige vira, så den nuværende tankegang er, at dette er en del af et gammelt immunsystem, der beskytter bakterier og archaea mod vira. Hypotesen er, at hvis det er lykkedes en bakterie at overleve en virusinfektion, det tilføjer et stykke af virusets genetiske kode til dets genom som et minde om infektionen.
Ingen ved endnu, hvordan alt dette fungerer, siger hendes kollega, men mistanken er, at mekanismen, der bruges af bakterier til at neutralisere en virus, ligner den, der blev undersøgt af Doudna:RNA -interferens.
Doudna kortlægger et komplekst maskineri
Denne nyhed er både bemærkelsesværdig og spændende. Hvis det er rigtigt, at bakterier har et gammelt immunsystem, så er det en stor ting. Jennifer Doudnas fornemmelse af molekylære intriger kommer til live, og hun begynder at lære alt, hvad hun kan om CRISPR -systemet.
Det viser sig at, ud over CRISPR -sekvenserne, forskere har opdaget særlige gener, som de har kaldt CRISPR-associerede, forkortet som cas. Det, Doudna finder interessant, er, at disse gener ligner meget gener, der koder for allerede kendte proteiner, der specialiserer sig i at afvikle og skære DNA op. Så har Cas -proteinerne den samme funktion? Kløver de virus -DNA?
Hun sætter sin forskergruppe i gang, og efter nogle år, det er lykkedes dem at afsløre funktionen af flere forskellige Cas -proteiner. Parallelt, en håndfuld andre forskergrupper ved andre universiteter studerer det nyopdagede CRISPR/Cas -system. Deres kortlægning viser, at bakteriers immunsystem kan antage meget forskellige former. CRISPR/Cas -systemet undersøgt af Doudna tilhører klasse 1; det er et komplekst maskineri, der kræver mange forskellige Cas -proteiner for at afvæbne en virus. Klasse 2 -systemerne er betydeligt enklere, fordi de har brug for færre proteiner. I en anden del af verden, Emmanuelle Charpentier er lige stødt på sådan et system. Tilbage til hende.
En ny og ukendt brik i CRISPR-systemets puslespil
Da vi forlod Emmanuelle Charpentier, boede hun i Wien, men i 2009 flyttede hun til en stilling med gode forskningsmuligheder ved Umeå Universitet i det nordlige Sverige. Hun blev advaret om at flytte til en så fjerntliggende del af verden, men den lange, mørk vinter giver hende masser af fred og ro til arbejdet.
Og hun har brug for det. Hun er også interesseret i små, genregulerende RNA-molekyler og, arbejder med forskere i Berlin, hun har kortlagt de små RNA'er, der findes i S. pyogenes. Resultaterne har givet hende meget at tænke over, fordi et af de små RNA -molekyler, der findes i store mængder i denne bakterie, er en endnu ukendt variant, og den genetiske kode for dette RNA er meget tæt på den særegne CRISPR -sekvens i bakteriens genom.
Lighederne mellem de to får Charpentier til at mistanke om, at de er forbundet. Omhyggelig analyse af deres genetiske koder afslører også, at en del af det lille og ukendte RNA -molekyle matcher den del af CRISPR, der gentages. Det er som at finde to puslespil, der passer perfekt sammen.
Charpentier havde aldrig arbejdet med CRISPR, men hendes forskergruppe indleder et grundigt mikrobiologisk detektivarbejde for at kortlægge CRISPR -systemet i S. pyogenes. Dette system, der hører til klasse 2, var allerede kendt for kun at kræve et enkelt Cas -protein, Cas9, at spalte virus -DNA. Charpentier viser, at det ukendte RNA -molekyle, som hedder transaktiverende crispr RNA (tracrRNA), har også en afgørende funktion; det er nødvendigt for det lange RNA, der er skabt fra CRISPR -sekvensen i genomet, til at modnes til dets aktive form.
Efter intensivt og målrettet forsøg, Emmanuelle Charpentier offentliggør opdagelsen af tracrRNA i marts 2011. Hun ved, at hun er i hælene på noget meget spændende. Hun har mange års erfaring inden for mikrobiologi og i sin fortsatte undersøgelse af CRISPR-Cas9-systemet ønsker hun at samarbejde med en biokemiker. Jennifer Doudna er det naturlige valg. Så det forår, når Charpentier inviteres til en konference i Puerto Rico for at fortælle om hendes fund, hendes mål er at møde denne dygtige Berkeley -forsker.
Et livsforandrende møde i en puertoricansk café
Ved et tilfælde, de mødes på en café på konferencens anden dag. En kollega til Doudna introducerer dem for hinanden og, den følgende dag, Charpentier foreslår, at de sammen skal udforske de gamle dele af hovedstaden. Når de spadserer langs de brostensbelagte gader, de begynder at tale om deres forskning. Charpentier spekulerer på, om Doudna er interesseret i et samarbejde - vil hun gerne deltage i at studere funktionen af Cas9 i S. pyogenes 'simple klasse 2 -system?
Jennifer Doudna er fascineret, og de og deres kolleger lægger planer for projektet via digitale møder. Deres mistanke er, at CRISPR-RNA er nødvendig for at identificere et viruss DNA, og at Cas9 er saksen, der skærer DNA -molekylet af. Imidlertid, der sker ikke noget, når de tester dette in vitro. DNA -molekylet forbliver intakt. Hvorfor? Er der noget galt med de eksperimentelle forhold? Eller har Cas9 en helt anden funktion?
Efter en masse brainstorming og talrige mislykkede eksperimenter, forskerne tilføjer endelig tracrRNA til deres test. Tidligere har de mente, at tracrRNA kun var nødvendig, når CRISPR-RNA blev spaltet i sin aktive form, men når Cas9 havde adgang til tracrRNA, hvad der alle ventede på, skete der faktisk:DNA-molekylet blev delt i to dele.
Evolutionære løsninger har ofte overrasket forskere, men dette var noget ekstraordinært. Det våben, streptokokker har udviklet som en beskyttelse mod vira, er enkelt og effektivt, endda genialt. Den genetiske sakses historie kunne have stoppet her; Charpentier og Doudna havde afdækket en grundlæggende mekanisme i en bakterie, der forårsager stor lidelse for menneskeheden. Denne opdagelse var forbløffende i sig selv, men tilfældighed favoriserer forberedte sind.
Et epokegørende eksperiment
Forskerne beslutter at forsøge at forenkle den genetiske sakse. Ved hjælp af deres nye viden om tracr-RNA og CRISPR-RNA, de fandt ud af, hvordan de kunne smelte de to sammen til et enkelt molekyle, som de kaldte guide RNA. Med denne forenklede variant af den genetiske sakse, de foretager derefter et epokegørende eksperiment:de undersøger, om de kan kontrollere dette genetiske værktøj, så det skærer DNA'et på et sted, forskerne har besluttet.
På dette tidspunkt, forskerne ved, at de er tæt på et stort gennembrud. De tager et gen, der allerede er i en fryser i Doudnas laboratorium og vælger fem forskellige steder, hvor genet skal spaltes. De ændrer derefter CRISPR -delen af saksen, så dens kode matcher koden, hvor nedskæringerne skal foretages. Resultatet var overvældende. DNA -molekylerne blev spaltet nøjagtigt de rigtige steder.
Genetisk saks ændrer biovidenskaben
Kort efter at Emmanuelle Charpentier og Jennifer Doudna offentliggjorde deres opdagelse af den genetiske sakse CRISPR/Cas9 i 2012, flere forskningsgrupper viser, at dette værktøj kan bruges til at ændre genomet i celler fra både mus og mennesker, fører til eksplosiv udvikling. Tidligere har ændring af generne i en celle, plante eller organisme var tidskrævende og undertiden umulig. Ved hjælp af den genetiske sakse, forskere kan - i princippet - foretage nedskæringer i det genom, de ønsker. Efter dette, det er let at udnytte cellens naturlige systemer til DNA -reparation, så de omskriver livskoden.
Fordi dette genværktøj er så let at bruge, den er nu udbredt inden for grundforskning. Det bruges til at ændre DNA fra celler og forsøgsdyr med det formål at forstå, hvordan forskellige gener fungerer og interagerer, såsom i løbet af en sygdom.
Genetisk saks er også blevet et standardværktøj inden for planteavl. De metoder, som forskere tidligere har brugt til at ændre plantegener, krævede ofte tilføjelse af gener til antibiotikaresistens. Da afgrøderne blev plantet, der var risiko for, at denne antibiotikaresistens spredte sig til de omgivende mikroorganismer. Takket være den genetiske sakse, forskere behøver ikke længere at bruge disse ældre metoder, da de nu kan foretage meget præcise ændringer i genomet. Blandt andet, de har redigeret de gener, der får ris til at absorbere tungmetaller fra jorden, hvilket fører til forbedrede rissorter med lavere niveauer af cadmium og arsen. Forskere har også udviklet afgrøder, der bedre kan modstå tørke i et varmere klima, og som modstår insekter og skadedyr, der ellers skulle håndteres ved hjælp af pesticider.
Håb om at helbrede arvelige sygdomme
I medicin, den genetiske sakse bidrager til nye immunterapier mod kræft, og forsøg er i gang for at gøre en drøm til virkelighed - helbredelse af arvelige sygdomme. Forskere udfører allerede kliniske forsøg for at undersøge, om de kan bruge CRISPR/Cas9 til behandling af blodsygdomme som seglcelleanæmi og beta -thalassæmi, samt arvelige øjensygdomme.
De udvikler også metoder til reparation af gener i store organer, såsom hjerne og muskler. Dyreforsøg har vist, at specialdesignede vira kan levere den genetiske sakse til de ønskede celler, behandling af modeller for ødelæggende arvelige sygdomme, såsom muskeldystrofi, spinal muskelatrofi og Huntingtons sygdom. Imidlertid, teknologien har brug for yderligere forfining, før den kan testes på mennesker.
Den genetiske sakses kraft kræver regulering
Ud over alle deres fordele, genetisk saks kan også misbruges. For eksempel, dette værktøj kan bruges til at skabe genetisk modificerede embryoner. Imidlertid, i mange år har der været love og regler, der kontrollerer anvendelsen af genteknik, som inkluderer forbud mod at ændre det menneskelige genom på en måde, der gør det muligt at arve ændringerne. Også, forsøg, der involverer mennesker og dyr, skal altid gennemgås og godkendes af etiske udvalg, før de udføres.
En ting er sikkert:Disse genetiske saks påvirker os alle. Vi vil stå over for nye etiske spørgsmål, men dette nye værktøj kan meget vel bidrage til at løse mange af de udfordringer, menneskeheden nu står over for. Gennem deres opdagelse, Emmanuelle Charpentier og Jennifer Doudna udviklede et kemisk værktøj, der har taget biovidenskab ind i en ny epoke. De har fået os til at se ud på en enorm horisont med uanede potentialer og, undervejs - mens vi udforsker dette nye land - vil vi med garanti foretage nye og uventede opdagelser.
© 2020 Associated Press. Alle rettigheder forbeholdes. Dette materiale må ikke offentliggøres, udsende, omskrevet eller omfordelt uden tilladelse.
 Varme artikler
Varme artikler
-
 Forvandling af plastikaffald til brintgas og kulstofnanorørKredit:Unsplash/CC0 Public Domain Et team af forskere fra Storbritannien, Kina, og Saudi-Arabien har udviklet en proces til at omdanne plastikaffald til brintgas og kulstofnanorør. I deres papir o
Forvandling af plastikaffald til brintgas og kulstofnanorørKredit:Unsplash/CC0 Public Domain Et team af forskere fra Storbritannien, Kina, og Saudi-Arabien har udviklet en proces til at omdanne plastikaffald til brintgas og kulstofnanorør. I deres papir o -
 Affalds-humlestængel i ølindustrien upcycled til cellulosenanofibreCellulose-nanofibre blev fremstillet af affaldshoppestammer ved TEMPO-medieret oxidation. Kredit:Yokohama National University Cirka tre fjerdedele af biomassen i humleplanter, der bruges til ølfre
Affalds-humlestængel i ølindustrien upcycled til cellulosenanofibreCellulose-nanofibre blev fremstillet af affaldshoppestammer ved TEMPO-medieret oxidation. Kredit:Yokohama National University Cirka tre fjerdedele af biomassen i humleplanter, der bruges til ølfre -
 Forbedring af observation af proteinbindingForskere byggede optiske værktøjer kaldet nul-mode bølgeledere, illustreret her, bruges til at observere proteiner, der er impliceret i menneskets hjertefunktion. Kredit:David S. White/University of W
Forbedring af observation af proteinbindingForskere byggede optiske værktøjer kaldet nul-mode bølgeledere, illustreret her, bruges til at observere proteiner, der er impliceret i menneskets hjertefunktion. Kredit:David S. White/University of W -
 3D-udskrivning gør nanomaskiner til arbejdere i stor størrelseEn 3D-trykt gelstruktur løfter og sænker en krone i USA, når den skiftevis udsættes for vand og DMSO-opløsningsmiddel. Kredit:© Chenfeng Ke Ved hjælp af avanceret 3D-udskrivning, Dartmouth College
3D-udskrivning gør nanomaskiner til arbejdere i stor størrelseEn 3D-trykt gelstruktur løfter og sænker en krone i USA, når den skiftevis udsættes for vand og DMSO-opløsningsmiddel. Kredit:© Chenfeng Ke Ved hjælp af avanceret 3D-udskrivning, Dartmouth College
- Lysekkoer i Eta Carinae-tågen
- Nye statistikapps viser en virtuel virkelighed
- Hvad er Silent Aircraft Initiative?
- ATLAS Experiment frigiver ny søgning efter partikler med lang levetid
- Celle-afledte lægemiddelleveringssystemer
- Første lockdowns effekt på luftforurening blev overvurderet, vores undersøgelse afslører


