Gastrointestinal-resident, formskiftende mikrodele til forlænget lægemiddeltilførsel
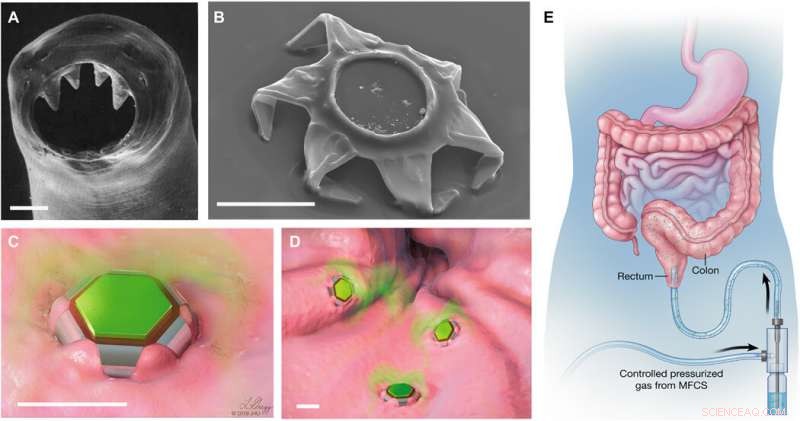
Formskiftende behandlere som selvlåsende medicinleveringsenheder. (A) Scanning elektronmikroskopi (SEM) billede af ventrikeltænderne på hookworm A. duodenale. Ormen bruger disse skarpe tænder til at trænge ind i slimhinden og klæber i mave -tarmkanalen i op til 2 år. Genoptrykt fra Human Parasitology, 4. udgave. Copyright 2013, med tilladelse fra Elsevier. (B) SEM -billede af en theragripper i den lukkede konfiguration. Ligesom krogormen, theragrippers er udstyret med skarpe mikrotips. Skematiske illustrationer af (C) en enkelt og (D) mange behandlere knyttet til slimhindevævet og frigiver indkapslet lægemiddel (farvet i grønt). Målestænger, 100 um (A til D). (E) Konceptuel illustration af rektal administration af lægemiddelbelastede theragrippers ved hjælp af en trykaktiveret mikrofluidisk flowkontroller. Billeder (C) til (E) blev illustreret af L. Gregg. MFCS, mikrofluidisk flowkontrolsystem. Kredit:Science Advances, doi:10.1126/sciadv.abb4133
Online coverhistorien om Videnskab fremskridt denne uge indeholder en konceptuel gastrointestinal (GI) mikroenhed, udviklet af et forskerhold for forlænget frigivelse af lægemidler. Lægemiddelleveringsplatforme til forlænget frigivelse af lægemidler har vist sig at være udfordrende at udvikle inden for bioingeniør på grund af mave -tarm -bevægelser (GI) og deres resulterende eliminering fra kroppen. I en ny rapport, Arijit Ghosh og et team af tværfaglige forskere inden for kemisk og biomolekylær teknik, gastroenterologi og hepatologi, materialevidenskab, opdagelse af lægemidler og neurologi ved Johns Hopkins University i USA rapporterede om nye lægemiddelbelastede enheder, der er bioinspireret af grebsmekanismerne for parasitære rundorme kendt som krogorm. Parasitterne kan blive hængende i tyndtarmen i længere tidsperioder, der fodrer med deres værts blod.
Ghosh et al. designet og udviklet en gribende konstruktion, de kaldte theragrippers for at grave deres kløer ind i slimhindevævet i tarmkanalen. Enhederne udførte gribende som reaktion på kropsvarme eller andre biologiske signaler og frigav medicin i GI -lumen. Som bevis på konceptet, de viste, hvordan enhederne klamrede sig til mave-tarmkanalen for levende rotter i 24 timer og demonstrerede en seks gange stigning i eliminationshalveringstiden for et ikke-steroidalt antiinflammatorisk lægemiddel, der bruges til at lindre moderate smerter. Arbejdet viste, at enheden hjalp stoffet med at forblive i kroppen i en betydeligt længere periode. Arbejdet giver førsteklasses bevis på selvlåsende mikrodele til effektivt at forbedre langvarig og forbedret lægemiddeltilførsel.
Levering af lægemidler i mave -tarmkanalen
I dette arbejde, Ghosh et al. blev inspireret af biomekanismen i Ancylostoma duodenale (hookworms), der opholder sig i tarmene i op til to år. Arbejdet præsenterede det første prækliniske bevis for submillimeter-skala låseværktøjer til forbedret frigivelse og fastholdelse af lægemidler in vivo. Lægemiddeladministration gennem mave -tarmkanalen kan forbedre compliance i forhold til injicerbare stoffer, resulterer i bedre behandling. Lægemidler administreret gennem mave -tarmkanalen muliggør effektiv absorption og systemisk cirkulation på grund af det enorme tarmoverflade og rige vaskularisering af mave -tarmkanalen. For eksempel, forskere havde tidligere udviklet slimpenetrerende partikler (MPP'er) til forbedret fastholdelse, selvom sådanne anordninger blev fjernet efter en dag på grund af clearance af det underliggende slimlag. Der er derfor i øjeblikket et presserende behov for at udvikle udvidede lægemiddelleveringssystemer.
Skematisk fremstilling af hookworm-inspirerede mikroenheder, der forbedrede udvidet lægemiddelSkematisk fremstilling af hookworm-inspirerede mikroenheder, der forbedrede udvidet lægemiddeltilførsel hos rotter. Billedkredit:Lydia Gregg 2020 JHU, Videnskabelige fremskridt, doi:10.1126/sciadv.abb4133 levering hos rotter. Billedkredit:Lydia Gregg 2020 JHU, Videnskabelige fremskridt, doi:10.1126/sciadv.abb4133
Eksperimentet:Udvikling af behandlere
For at opnå automatisk låsning i GI -lumen, Ghosh et al. stolede på den termisk udløste frigivelse af enheden. De låste et lægemiddelbelastningsplaster på mikroaktuatorerne for at levere ketorolac (en smertelindring) som model. Theragripperne blev tilbageholdt i tyktarmen i 24 timer, tillader betydelig eksponering for stoffet, hvilket resulterer i en 10 gange højere plasmaketorolac-koncentration 12 timer efter administration. Proof-of-concept-arbejdet validerede det aktive, formskiftende og selvlåsende behandlere til forlænget frigivelse af lægemidler i mave-tarmkanalen. Forskerne brugte flere skarpe mikrotips til at designe teragripperne for at sikre fastlåsning til GI -slimhinden ligesom krogeorm. De dækkede det tykke, stive segmenter og dobbeltlags hængsler på teragripperne med et termofølsomt vokslag. Enhedens overfladeparaffin eller vokslag blødgøres ved kropstemperatur efter implantation for autonomt at udløse kløerne inde i GI -kanalen i dyremodellen.
Teamet brugte hybridmaterialer indeholdende en metalpolymer fremstillet af guld og chrom og bærer et lægemiddel-eluerende polymerplaster til kontrolleret frigivelse af lægemidler. Adhæsivstyrken af den lægemiddelbelastede polymer til det underliggende metalstillads forhindrede delaminering (fjernelse) af lægemiddelplasteret under GI-peristaltikken. Materialerne var biokompatible uden potentiel toksicitet for lægemiddelafgivelse. Teamet valgte den rektale vej til enhedsadministration, der er mest almindelig for pædiatriske patienter og i terapeutiske indgreb for ulcerøs colitis.
Fluorescein muliggjorde visualisering af kemisk frigivelse fra behandlere. Kredit:Science Advances, doi:10.1126/sciadv.abb4133 
Ghosh et al. først afstemt porøsiteten af lægemiddelplasteret, der er elektrodeponeret på enheden for at indlæse og frigive medicin i 24 timer. De brugte ketorolac, godkendt af U.S. Food and Drug Administration, ikke-steroide, antiinflammatorisk lægemiddel som modelkandidat med en høj clearanceprofil (halveringstid på mindre end 3 timer) til in vivo-forsøg i en gnavermodel. Polymerens porestørrelse letter frigivelsen af betydelige mængder ketorolac med en acceptabel hastighed, og teamet brugte 250 µm store teragrippere til in vivo lægemiddellevering hos rotter. Konstruktionerne var 32 gange mindre end den typiske tyktarmsdiameter hos rotter og vejede cirka 300 g. Ghosh et al. afstemt theragripper -penetrationen ved at variere parametrene for konstruktionen, og brugte den endelige elementmetode til at estimere den kraft, der genereres af enhedens foldekløer. Teamet anvendte en begrænsning på spidsen af theragripperen for at forhindre, at den foldede sig under simuleringerne og beregnede det omtrentlige tryk for hver theragripper -mikrotip på tyktarmen - som var i området 0,4 til 0,6 MPa. Resultaterne indikerede deres potentiale til at udøve tilstrækkeligt tryk til at bryde slimhindebarrieren uden at skade tyktarmen.
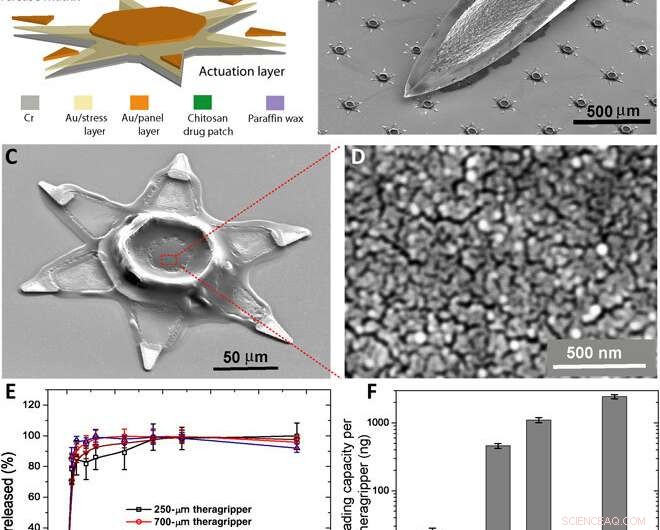
Parallel fremstilling af teragripperne og deres in vitro lægemiddelindlæsning og frigivelsesegenskaber. (A) Funktionelt blokdiagram, der illustrerer mikrofabrikationstrinnene for en række theragrippers, viser aktiveringslaget, lægemiddel-eluerende lag, og den termoresponsive trigger. (B) SEM-billede, der viser theragrippers ved siden af spidsen af en 22-gauge injektionsnål. Theragripperne er små nok til at passere sikkert gennem mave -tarmkanalen uden at forårsage maveobstruktion. (C) SEM -billede, der viser et enkelt 250 μm, as fabricated theragripper with the drug-encapsulated chitosan patch at the center and the paraffin wax trigger layer on the hinges. (D) High-resolution SEM image showing the surface morphology of the chitosan patch at the center of the theragripper. The patch has pores less than 100 nm in size. (E) Release characteristics of ketorolac (KT) from theragrippers of four different sizes. (F) Plot showing the relative scaling of the drug loading capacity of theragrippers of different sizes. The entire loaded drug gets released over a period of 24 hours. While the 250-μm theragrippers were used for our in vivo experiments in rats, larger 1.5-mm theragrippers can be loaded with about 100 times more drug, for use in larger animal models and humans. Kredit:Science Advances, doi:10.1126/sciadv.abb4133
Ex vivo and in vivo attachment followed by systemic drug delivery
The team performed ex vivo (experiments on tissue conducted externally in a laboratory) theragripper attachment studies using rat colon tissue and visualized surface penetration using scanning electron microscopy (SEM). During in vivo experiments in rats, Ghosh et al. deployed thousands of grippers in a single shot by using a pneumatic microfluidic controller (PMC). The team delivered the drug deploying theragrippers intrarectally via a pneumatic delivery system to jugular vein cannulated rats. The rat colon appeared normal at the sites of attachment, indicating the absence of tissue damage or inflammation. The team also conducted similar experiments with a porcine (pig) model to understand theragrippers as a resident device in the upper GI tract. During these investigations, the device transited through the esophagus in less than a minute and remained attached to the colon for up to a day. All experiments demonstrated the safe elimination of the grippers from the body through natural mucosal turnover. Each theragripper contained approximately 23 nanograms of ketorolac for sustained drug concentrations and showed delayed clearance compared with pristine ketorolac.
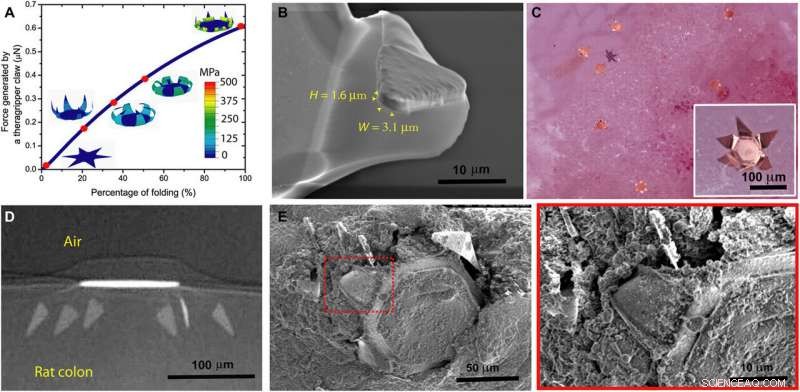
Theragrippers can apply sufficient force to penetrate the mucosa. (A) Plot of the force generated by a theragripper as a function of the percentage of folding, generated by FEM. Each claw of the theragripper can generate a maximum force of around 0.6 μN per hinge. Insets show the simulated configurations at different stages of the folding process marked by red dots. The colors in the legend indicate the magnitude of the von Mises stress in the gripper. (B) Close-up SEM image of the tip of a theragripper, showing the cross section of the tip having a width (W) of approximately 3.1 μm and a height (H) of 1.6 μm. To estimate the pressure exerted by this tip as the gripper actuates, we used the Hertz contact mechanics model and assumed the tip to be a sphere of diameter 1.6 to 3.1 μm. (C) Ex vivo experiment showing many theragrippers latching onto the colon of a rat. The inset shows the bright-field zoomed-in image of a single theragripper. (D) μ-CT image of the cross section of a theragripper penetrating into the colon ex vivo. (E) SEM image of a theragripper latching onto the colon mucosa ex vivo. (F) Zoomed-in image of the red outlined region in (E), showing the penetration of the claw into the colon tissue. Kredit:Science Advances, doi:10.1126/sciadv.abb4133
På denne måde, Arijit Ghosh and colleagues developed a versatile platform of thermoresponsive theragrippers for drug dispersion in smaller conduits within the body. The team markedly improved the performance by altering the geometry, hydrogel matrix and drug formulation to observe drug release and the retention of grippers in the colon for 24 hours. Due to the thermoresponsive nature of theragrippers, the team will need to refrigerate the devices for immediate and long-term storage. They conducted proof-of-concept studies with the model drug ketorolac, which showed an increased half-life of almost 12 hours, the concept can be extended to other drugs. The new and versatile theragripper drug delivery system is based on self-latching in live animals and presents a new paradigm in drug administration.
© 2020 Science X Network
Sidste artikelForskere 3-D-printer biomedicinske dele med supersonisk hastighed
Næste artikelDet vedvarende problem med 1, 4-dioxan i vand
 Varme artikler
Varme artikler
-
 Immunsystemets frontlinjeforsvar fryser bakterier i deres sporSporene fra snesevis af individuelle ribosomer, som bygger proteiner i celler, der blev identificeret fra en enkelt bakteriecelle ved hjælp af en mikroskopisk teknik, der kan følge bevægelsen af ind
Immunsystemets frontlinjeforsvar fryser bakterier i deres sporSporene fra snesevis af individuelle ribosomer, som bygger proteiner i celler, der blev identificeret fra en enkelt bakteriecelle ved hjælp af en mikroskopisk teknik, der kan følge bevægelsen af ind -
 Guld nanopartikler til at finde anvendelser i brintøkonomiDen internationale videnskabelige gruppe udførte forsøget med halvleder baseret på titaniumdioxid. Kredit:Peter den Store St.Petersburg Polytechnic University Et internationalt hold af videnskabsm
Guld nanopartikler til at finde anvendelser i brintøkonomiDen internationale videnskabelige gruppe udførte forsøget med halvleder baseret på titaniumdioxid. Kredit:Peter den Store St.Petersburg Polytechnic University Et internationalt hold af videnskabsm -
 Dengue -infektion korrelerer med dynamik snarere end morfologierKredit:National University of Singapore NUS -biofysikere har opdaget nye konformationsændringer og strukturelle dynamikker af denguevirus under deres overførsel til menneskelige værter. Dengue-in
Dengue -infektion korrelerer med dynamik snarere end morfologierKredit:National University of Singapore NUS -biofysikere har opdaget nye konformationsændringer og strukturelle dynamikker af denguevirus under deres overførsel til menneskelige værter. Dengue-in -
 Forskere udvikler den første funktionelle ikke-native metalhydrogenaseKredit:CC0 Public Domain Hydrogenaser er enzymer, der katalyserer hydrogenaktivering. Der er tre typer hydrogenaser i naturen, alle indeholder jern og nogle af dem nikkel. Men i syntetisk kemi er
Forskere udvikler den første funktionelle ikke-native metalhydrogenaseKredit:CC0 Public Domain Hydrogenaser er enzymer, der katalyserer hydrogenaktivering. Der er tre typer hydrogenaser i naturen, alle indeholder jern og nogle af dem nikkel. Men i syntetisk kemi er
- For at spare energi, AI rydder op i overskyede vejrudsigter
- Hubbles det indflydelsesrige liv sammen med rumaffald
- Videnskabsfakta om magneter til Kids
- Ændringer er nødvendige for at finansiere amerikansk vandinfrastruktur
- Frankrig vil søge hårdere tilsyn med 5G-netværksudstyr
- Astronomer opdager supermassive sorte hul i en ultrakompakt dværggalakse


