Forskere observerer direkte membranbindingen af α-synuclein i levende celler
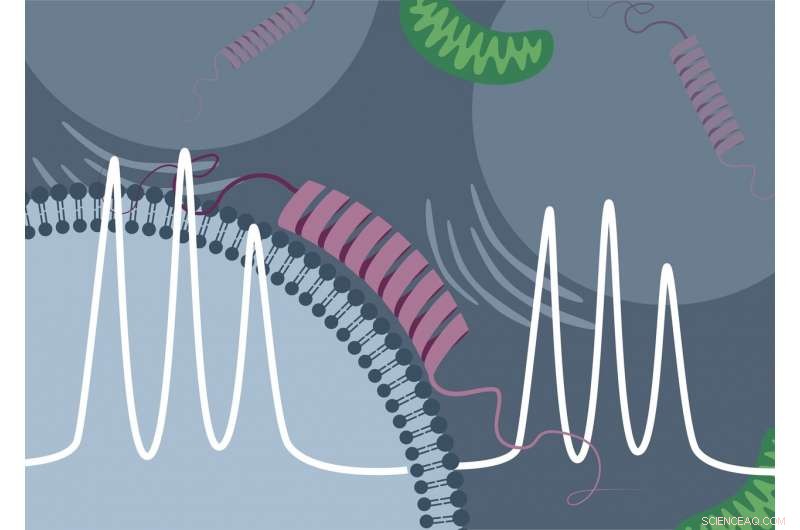
Forskere fra University of Konstanz og Free University of Amsterdam, i samarbejde med Bruker BioSpin udviklingsteamet, har for første gang haft held med den direkte spektroskopiske påvisning af bindingen af "Parkinson-proteinet" α-synuclein til lipidmembraner i cellen. Kredit:Malte Drescher Lab - University of Konstanz
Proteinet α-synuclein er et af de mest udbredte proteiner i den menneskelige hjerne. Det omtales ofte som "Parkinson-proteinet, ", da aflejring af dette protein i hjerneceller er et kendetegn for Parkinsons sygdom. På trods af den store interesse for biomedicinsk forskning i proteinet, mange spørgsmål vedrørende α-synucleins funktion og fysiologi i levende celler mangler stadig at blive besvaret. For eksempel, det var tidligere uklart, om og i hvilket omfang proteinet binder til og interagerer med interne cellekomponenter såsom membraner.
Da sådanne processer kan spille en rolle i udviklingen af sygdommen, holdet ledet af den Konstanz-baserede fysisk kemiker professor Malte Drescher brugte videreudviklingen af en etableret målemetode kaldet elektronparamagnetisk resonansspektroskopi (EPR-spektroskopi) til at lære mere om Parkinsons proteins bindingsegenskaber. Studiet, offentliggjort i det videnskabelige tidsskrift The Journal of Physical Chemistry Letters , leverer proof of concept, at den avancerede metode er grundlæggende egnet til at belyse protein-lipid-interaktioner i celler. Desuden, denne første praktiske test gav direkte bevis for bindingen af α-synuclein til intracellulære membraner.
Langsommere er ikke altid mere grundigt
Den avancerede version af EPJ-spektroskopi, i den aktuelle undersøgelse, der for første gang anvendes i praksis, kaldes hurtig-scanning EPJ-spektroskopi. I begge metoder, det konventionelle og det avancerede, proteinerne, der skal undersøges, udstyres først med såkaldte spin-prober. Disse kemiske prober gør det muligt at detektere ændringer i proteinstrukturen. Spin-prober har hver en fri elektron, hvis spin exciteres ved bestråling med mikrobølger. "Vi kan forestille os spins som små kompasnåle, der er påvirket af mikrobølgebestråling under målingen, " forklarer Drescher. I konventionel EPJ-spektroskopi, for hver gruppe af spændte spins er det nødvendigt at vente, indtil denne indflydelse falder, før gruppen kan spændes igen. Denne relativt tidskrævende proces skal gentages over mange omgange for at opnå den komplette måling.
Med hurtig scanning EPJ spektroskopi, derimod det er ikke længere nødvendigt at vente, indtil påvirkningen af en spingruppe aftager, før målingen fortsættes. "I stedet, du skynder dig påvirkningen spektralt fra spin-gruppe til spin-gruppe og vender derefter tilbage til den første gruppe i det øjeblik, hvor dens excitation lige er aftaget, " siger Drescher. På den ene side, denne procedure forkorter den nødvendige måletid, mens den på den anden side tillader anvendelse af højere mikrobølgeeffekt, fører til forbedret nøjagtighed af metoden. Forskerne har gjort brug af begge disse fordele i deres nuværende undersøgelse af α-synucleins bindingsadfærd.
Den nye metode i praksis
Fra tidligere undersøgelser udført in vitro ("i reagensglasset") var det allerede kendt, at "Parkinson-proteinet" α-synuclein kan binde sig til elektrisk negativt ladede lipidmembraner. I EPJ-spektroskopi, denne bindingsproces er ledsaget af en karakteristisk ændring i det målte signal. "Det oprindeligt uordnede α-synuclein antager en ordnet form ved binding til membranen. Dette reducerer mobiliteten af spinproben, og bindingen af proteinet kan påvises direkte ved målemetoden, " forklarer Theresa Braun, ph.d.-studerende i Dreschers forskerhold og, sammen med Juliane Stehle, hovedforfatter af undersøgelsen.
Ved hjælp af syntetisk, negativt ladede membranvesikler og oprenset α-synuclein, Drescher og hans kolleger var i stand til at detektere den samme signalændring i hurtig-scanning EPR-spektroskopi. Imidlertid, de lykkedes ikke kun in vitro, men også inde i celler fra den afrikanske kløvede frø (Xenopus laevis), hvori først de kunstige membranvesikler blev indført og, kort tid senere, proteinet var. Forskerholdet udførte derefter tidsafhængige målinger og var i stand til direkte at observere, baseret på ændringen i målesignalet, hvordan andelen af proteinet bundet i cellen steg over tid.
En sammenlignelig - om end væsentligt svagere - stigning i mængden af bundet α-synuclein over tid blev også set, når der ikke blev indført kunstige membraner i cellen. Dermed, ifølge Drescher, kun én forklaring var tilbage på denne afgørende observation. "Dette er første gang, vi ser direkte beviser for, at α-synuclein interagerer med det endogene, dvs. også naturligt eksisterende lipidmembraner, " konkluderer videnskabsmanden. På grund af den forholdsvis lille størrelse af effekten, i forsøg med mindre præcise målemetoder havde dette tidligere holdt sig skjult.
Fra frø til menneske
I fremtidige undersøgelser, Malte Dreschers team planlægger at bygge videre på dette resultat og yderligere belyse processen med intracellulær binding af α-synuclein til naturlige cellekomponenter, for at lære mere om proteinets funktion. Et vigtigt skridt i denne proces vil være overgangen fra frøceller som et modelsystem til forskellige pattedyrcelletyper. Det langsigtede mål er bedre at forstå protein-lipid-interaktionerne af "Parkinson-proteinet" og dets rolle i udviklingen af Parkinsons sygdom for at kunne udvikle passende terapeutiske tilgange.
 Varme artikler
Varme artikler
-
 Ideel metode til hurtig sygdomstestningKredit:Pixabay I den pandemiske tidsalder med telesundhed og nye teknologier, remote site lab eller point-of-care (POC) test af biovæsker er en potentielt hurtig og ikke-invasiv måde at teste for
Ideel metode til hurtig sygdomstestningKredit:Pixabay I den pandemiske tidsalder med telesundhed og nye teknologier, remote site lab eller point-of-care (POC) test af biovæsker er en potentielt hurtig og ikke-invasiv måde at teste for -
 Forskning i brugsklar terapeutisk mad søger drastisk reduktion af dødsfald som følge af alvorlig …MIT kandidatstuderende Tonghan Gu (til højre) arbejder med teknikere på en facilitet i Vasai, Indien, at producere et parti brugsklare terapeutiske fødevarer i pulverform. Formlen, han har udviklet, b
Forskning i brugsklar terapeutisk mad søger drastisk reduktion af dødsfald som følge af alvorlig …MIT kandidatstuderende Tonghan Gu (til højre) arbejder med teknikere på en facilitet i Vasai, Indien, at producere et parti brugsklare terapeutiske fødevarer i pulverform. Formlen, han har udviklet, b -
 Sporing af pileups på batteriopladningsruten for at øge ydeevnenEn illustration af de strukturelle ændringer, der forekommer ved en metaloxidelektrode under battericykling. Den inderste cirkel viser strukturelle ændringer under lithiumekstraktion og lithiumindsætt
Sporing af pileups på batteriopladningsruten for at øge ydeevnenEn illustration af de strukturelle ændringer, der forekommer ved en metaloxidelektrode under battericykling. Den inderste cirkel viser strukturelle ændringer under lithiumekstraktion og lithiumindsætt -
 Infrarød sensor fungerer som et nyt værktøj til opdagelse af lægemidlerKredit:Sisacom, Shutterstock Forskere har fundet en ny metode til at analysere, hvordan aktive midler påvirker et specifikt protein, der er vigtigt for celleoverlevelse. Deres forskning kan hjælpe
Infrarød sensor fungerer som et nyt værktøj til opdagelse af lægemidlerKredit:Sisacom, Shutterstock Forskere har fundet en ny metode til at analysere, hvordan aktive midler påvirker et specifikt protein, der er vigtigt for celleoverlevelse. Deres forskning kan hjælpe
- APL foreslår Dragonfly-mission for at udforske potentielle beboelige steder på Saturns største må…
- Heres Hvordan slutningen af sommertid kan påvirke dig
- Tropisk vejr vipper Golfkysten med frisk vind, regn
- Forskere observerer interferenseffekt mellem Floquet kvasipartikler ved hjælp af strontium optisk g…
- Forskellen mellem forskningsspørgsmål & hypotese
- Kulstofbaserede tilgange til redning af regnskove bør omfatte biodiversitetsundersøgelser


