Forskere rapporterer omvendt magnesiumkemi opdagelse
Billede:Harder Group
Kemikere ved Friedrich-Alexander-Universitetet Erlangen-Nürnberg har offentliggjort et gennembrud inden for magnesiumkemi i tidsskriftet Natur .
Magnesium (Mg) er et jordrigt tidligt hovedgruppemetal med lav elektronegativitet, der let mister sine valenselektroner. I kombination med andre elementer, det forekommer naturligt kun i sin mest stabile form som positivt ladet Mg 2+ kation. Mg 2+ kation findes i forskellige mineraler, men også i klorofyl, pigmentet, der gør planter grønne. Magnesium i den unormale oxidationstilstand +I blev først opdaget i interstellare skyer, men for nylig, første komplekser med Mg + er blevet isoleret.
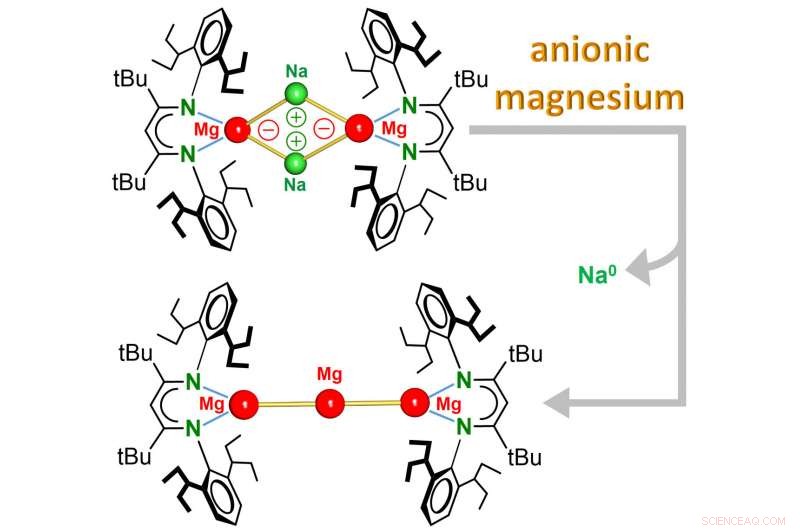
Holdet omkring prof. Sjoerd Harder (formand for uorganisk og metallisk kemi) rapporterer nu opdagelsen af den første Mg 0 komplekser, hvor metallet har en oxidationstilstand på nul og endda er negativt ladet. Disse komplekser, som indeholder unik magnesium-natriumbinding (Mg-Na), reagerer helt anderledes end almindelige Mg 2+ forbindelser. Mens elektronfattig Mg 2+ kationer kan acceptere elektroner, det elektronrige anioniske Mg 0 center reagerer ved at donere elektroner.
Komplekset er opløseligt i almindelige organiske opløsningsmidler og er et ekstremt stærkt reduktionsmiddel:Let opvarmning førte til øjeblikkelig reduktion af Na
+
kationer til Na
0
, et metal, der normalt har en stærk tendens til at oxidere til Na
+
kationer. Under denne termiske nedbrydning, der dannes en ny type kompleks, hvor tre Mg-atomer forbindes som perler i en kæde. Denne Mg
3
klynge reagerer som atomare Mg
0
og kunne ses som det mindste stykke Mg-metal, som er opløseligt i organiske opløsningsmidler. Denne nye klasse af anioniske Mg-komplekser vender helt op og ned på Mg-kemien. Yderligere usædvanlig reaktivitet af dette opløselige, ekstremt stærk, reduktionsmiddel kan forventes.
 Varme artikler
Varme artikler
-
 Fremtid for bærbar elektronik:Ny organisk halvleder med spændende egenskaberKredit:CC0 Public Domain Halvledere er stoffer, der har en ledningsevne mellem ledernes og isolatorernes. På grund af deres unikke egenskaber ved at lede strøm kun under særlige forhold, de kan ko
Fremtid for bærbar elektronik:Ny organisk halvleder med spændende egenskaberKredit:CC0 Public Domain Halvledere er stoffer, der har en ledningsevne mellem ledernes og isolatorernes. På grund af deres unikke egenskaber ved at lede strøm kun under særlige forhold, de kan ko -
 Forskere patenterer hurtige tests for kokainFIU biokemi Ph.D. studerende Haixiang Yu, kemi Ph.D. studerende Juan Canoura, og nyuddannet Obtin Alkhamis offentliggjorde en undersøgelse af FIUs patenterede kokaindetektionsteknologier. Kredit:Flori
Forskere patenterer hurtige tests for kokainFIU biokemi Ph.D. studerende Haixiang Yu, kemi Ph.D. studerende Juan Canoura, og nyuddannet Obtin Alkhamis offentliggjorde en undersøgelse af FIUs patenterede kokaindetektionsteknologier. Kredit:Flori -
 Økonomisk syntese af polyacrylater og polymethacrylater fra biobaserede materialerKredit:Angewandte Chemie På trods af industriens bedste indsats for at arbejde hen imod bæredygtighed, de fleste plastik (eller polymerer) er stadig fremstillet ved hjælp af ikke-fornybare fossile
Økonomisk syntese af polyacrylater og polymethacrylater fra biobaserede materialerKredit:Angewandte Chemie På trods af industriens bedste indsats for at arbejde hen imod bæredygtighed, de fleste plastik (eller polymerer) er stadig fremstillet ved hjælp af ikke-fornybare fossile -
 Gamle enzymer kan bidrage til grønnere kemiKredit: Kemisk Videnskab (2020). DOI:10.1039/D0SC01935F Et forskerhold ved Uppsala Universitet har genoplivet flere milliarder år gamle enzymer og omprogrammeret dem til at katalysere helt andre
Gamle enzymer kan bidrage til grønnere kemiKredit: Kemisk Videnskab (2020). DOI:10.1039/D0SC01935F Et forskerhold ved Uppsala Universitet har genoplivet flere milliarder år gamle enzymer og omprogrammeret dem til at katalysere helt andre
- Nanowire-brotransistorer åbner vejen for næste generations elektronik
- Stop med at skælde mænd ud for at være giftige
- Er mørkt stof ægte, eller har vi misforstået tyngdekraften?
- En foldekeramik
- Forskningssamarbejde anvender banebrydende teknologi til at producere nyt veterinærlægemiddel
- Stillehavet gør klar til Super Blood Moon himmelsk show


