Forskere kvantificerer termodynamisk samspil under proteinko-aggregering
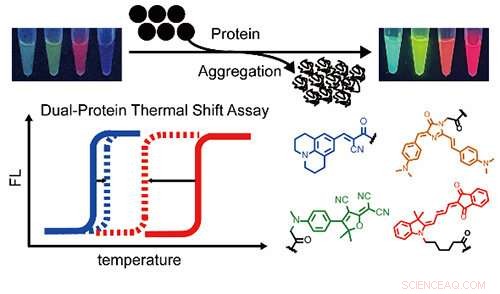
En række flerfarvede proteinaggregationssensorer og et termisk skift-assay med to farver til at rapportere om proteinko-aggregering af to forskellige proteiner samtidigt og kvantitativt. Kredit:BAI Yulong
Co-aggregering af flere patogene proteiner er almindelig i neurodegenerative sygdomme. Imidlertid, dekonvolutionen af en sådan biokemisk proces er stadig udfordrende.
For nylig, en forskergruppe ledet af Prof. Liu Yu fra Dalian Institute of Chemical Physics (DICP) fra det kinesiske videnskabsakademi udviklede et fluorogent fluorogent termisk skiftassay med to farver for samtidig at demonstrere sammenlægning af to forskellige proteiner og kvantitativt studere deres termodynamiske stabilitet under co-aggregering.
Denne undersøgelse blev offentliggjort i Kemisk videnskab .
Forskerne udviklede flerfarvede fluorogene proteinaggregationssensorer for at udvide spektral dækning. Derefter kvantificerede de ændringer i smeltetemperaturer i et heterozygot modelproteinsystem, som afslørede, at den termodynamiske stabilitet af vildtype proteiner blev signifikant kompromitteret af de mutante, men ikke omvendt.
De undersøgte også, hvordan små molekyler ligander selektivt og differentielt interfererede med et sådant samspil.
"Disse sensorer er velegnede til at visualisere, hvordan forskellige proteiner påvirker hinanden på deres co-aggregering i levende celler, "sagde professor Liu.
I særdeleshed, de undersøgte, hvordan amyloidogene transthyretin-proteiner interagerede med apolipoprotein IV-proteiner under deres co-aggregeringsproces, hvilket indikerede, at apolipoprotein IV var en farmakologisk chaperon.
 Varme artikler
Varme artikler
-
 Forskere rapporterer om ny klasse af polyethylenkatalysatorerOlafs Daugulis, Robert A. Welch Chair of Chemistry ved University of Houston, ledet et team, der opdagede en ny klasse af katalysatorer til fremstilling af ultra-højvægts polyethylen. Kredit:Universit
Forskere rapporterer om ny klasse af polyethylenkatalysatorerOlafs Daugulis, Robert A. Welch Chair of Chemistry ved University of Houston, ledet et team, der opdagede en ny klasse af katalysatorer til fremstilling af ultra-højvægts polyethylen. Kredit:Universit -
 Domino-lignende krystallisering af glasKredit:University of Tokyo Materialer i en glasagtig tilstand er overalt i vores liv og har bidraget til menneskeheden i mange år. I dag, de spiller en afgørende rolle i forskellige teknologier, h
Domino-lignende krystallisering af glasKredit:University of Tokyo Materialer i en glasagtig tilstand er overalt i vores liv og har bidraget til menneskeheden i mange år. I dag, de spiller en afgørende rolle i forskellige teknologier, h -
 Små molekylære bevægelser kan føre til mere effektive biobrændselscellerKredit:Leiden Universitet Leiden-forskere har fundet små bevægelser i laccase-enzymet. Denne opdagelse kan føre til udviklingen af meget mere effektive biobrændselsceller. Udgivelse i Biofysisk
Små molekylære bevægelser kan føre til mere effektive biobrændselscellerKredit:Leiden Universitet Leiden-forskere har fundet små bevægelser i laccase-enzymet. Denne opdagelse kan føre til udviklingen af meget mere effektive biobrændselsceller. Udgivelse i Biofysisk -
 Discovery booster teorien om, at liv på Jorden opstod fra RNA-DNA-blandingKredit:CC0 Public Domain Kemikere ved Scripps Research har gjort en opdagelse, der understøtter et overraskende nyt syn på, hvordan liv opstod på vores planet. I en undersøgelse offentliggjort i
Discovery booster teorien om, at liv på Jorden opstod fra RNA-DNA-blandingKredit:CC0 Public Domain Kemikere ved Scripps Research har gjort en opdagelse, der understøtter et overraskende nyt syn på, hvordan liv opstod på vores planet. I en undersøgelse offentliggjort i
- De underjordiske virkninger af jordskælv og vulkaner
- Hvilke organeller er membran Sacs brugt til transportmolekyler?
- Vil automatiserede køretøjer fjerne stressen fra at køre? Forskning siger, at man ikke skal regne…
- Sådan finder du watt med spænding og frekvens
- SpaceX er klar til at lancere en hemmelighedsfuld Zuma-mission
- Fokuser på en forstærkende læringsalgoritme, der kan lære af fiasko


