Hvilke af de følgende gasser ville have mest som en ideel gas: Han, NH3, Cl2 eller CO2?
Den ideelle gaslov beskriver, hvordan gasser opfører sig, men tager ikke højde for molekylær størrelse eller intermolekylære kræfter. Da molekyler og atomer i alle virkelige gasser har størrelse og udøver kraft på hinanden, er den ideelle gaslov kun en tilnærmelse, omend meget god for mange virkelige gasser. Det er mest nøjagtigt for monoatomiske gasser ved højtryk og temperatur, da det er for disse gasser, at størrelse og intermolekylære kræfter spiller den mest ubetydelige rolle.
Styrken af de intermolekylære kræfter
Afhængig af deres struktur , størrelse og andre egenskaber, forskellige forbindelser har forskellige intermolekylære kræfter - det er derfor, at vand koger ved en højere temperatur end f.eks. ethanol. I modsætning til de andre tre gasser er ammoniak et polært molekyle og kan hydrogenbindes, så det vil opleve stærkere intermolekylær tiltrækning end de andre. De øvrige tre er kun udsat for London spredningskræfter. London spredningskræfter er skabt af forbigående, kortvarig omfordeling af elektroner, der gør en molekyle handling som en svag midlertidig dipol. Molekylet kan så fremkalde polaritet i et andet molekyle, hvorved der skabes en attraktion mellem de to molekyler.
Bottom Line
I almindelighed er spredningskræfterne i London stærkere mellem større molekyler og svagere mellem mindre molekyler. Helium er den eneste monoatomiske gas i denne gruppe og dermed den mindste med hensyn til størrelse og diameter af de fire. Da den ideelle gaslov er en bedre tilnærmelse til monoatomiske gasser - og da helium er udsat for svagere intermolekylære attraktioner end de andre - ud af disse fire gasser er helium den, som vil opføre sig som en ideel gas.
Sidste artikelBortskaffelse af borsyre
Næste artikelSammensætning af mønter
 Varme artikler
Varme artikler
-
 Eksperimenter med fordampning og overfladeAlle væsker fordampes, hvis de udsættes for visse elementer. Den hastighed, hvormed en væske fordamper, afhænger af dens molekylstruktur. De andre faktorer, der påvirker fordampning, er overfladear
Eksperimenter med fordampning og overfladeAlle væsker fordampes, hvis de udsættes for visse elementer. Den hastighed, hvormed en væske fordamper, afhænger af dens molekylstruktur. De andre faktorer, der påvirker fordampning, er overfladear -
 Sådan bortskaffes methanolMethanol er en alkohol, der ofte bruges i laboratorieeksperimenter. Da det er brandfarligt og udgør sundhedsmæssige risici, er det vigtigt ikke at skylle methanol ned i drænet eller kombinere det med
Sådan bortskaffes methanolMethanol er en alkohol, der ofte bruges i laboratorieeksperimenter. Da det er brandfarligt og udgør sundhedsmæssige risici, er det vigtigt ikke at skylle methanol ned i drænet eller kombinere det med -
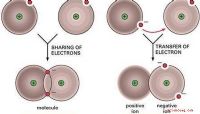 Definition af molekylære obligationerEn molekylær eller kovalent binding dannes, når atomer binder sig ved at dele par elektroner. Denne deling kan ske fra atom til atom eller fra et atom til en anden molekylær binding. Typer Det e
Definition af molekylære obligationerEn molekylær eller kovalent binding dannes, når atomer binder sig ved at dele par elektroner. Denne deling kan ske fra atom til atom eller fra et atom til en anden molekylær binding. Typer Det e -
 Hvorfor er der et lille hul i en vandpumpe?Jeg har et lille, ikke-tilsluttet hul foran i min vandpumpe. Hvad sker der med det? Har jeg mistet en bolt eller noget? Skal jeg tilslutte det med noget fugemasse eller skrue en bolt derinde, eller hv
Hvorfor er der et lille hul i en vandpumpe?Jeg har et lille, ikke-tilsluttet hul foran i min vandpumpe. Hvad sker der med det? Har jeg mistet en bolt eller noget? Skal jeg tilslutte det med noget fugemasse eller skrue en bolt derinde, eller hv


