Afdækning af ultrahurtig planteenzymdynamik kan fremme kornproduktion, medicinsk og farmaceutisk industri
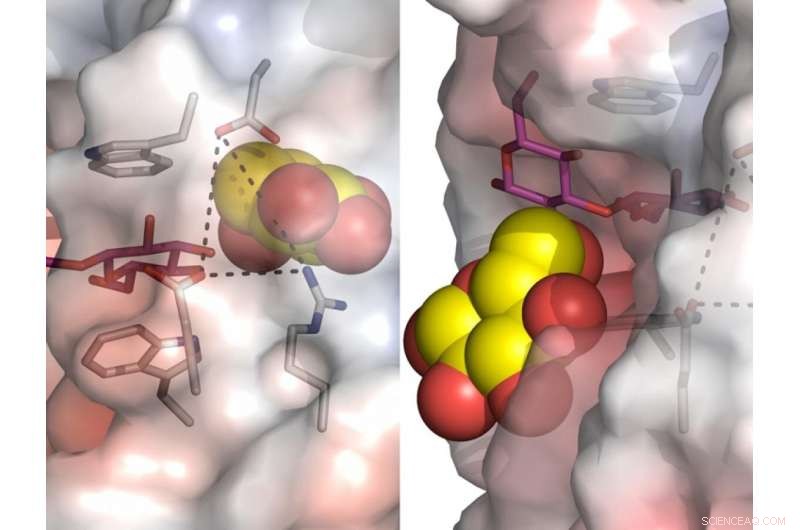
Strukturelle ændringer af et bygenzym, som forudset ved højopløsnings røntgenkrystallografi og multiskala molekylær modellering. Kredit:University of Adelaide
Forskere fra University of Adelaide har afsløret hidtil ukendte egenskaber i et planteenzym, der kan føre til fremskridt inden for kornproduktion, medicinsk og farmaceutisk industri.
Forskningen – offentliggjort i Nature Communications —har også potentiale til at blive anvendt til design af kemikalier, lægemidler, herbicider og pesticider, hvor enzymer er et miljøvenligt og omkostningseffektivt alternativ til nuværende metoder.
"Vi opdagede, at disse enzymer ikke er stive, som det ofte ses i krystalstrukturer, men er fleksible og tilbøjelige til bemærkelsesværdige ændringer i form," sagde projektleder Emerita Professor Maria Hrmova, fra University of Adelaides School of Agriculture, Food and Wine, og Waite Research Institute.
"Dette blev opnået ved at undersøge bindingsadfærden af sukkerarter i enzymet på ultrahurtige tidsskalaer.
"Vi løste 25 nye krystalstrukturer og kombinerede de strukturelle data med kraftig multi-skala modellering, som afslørede uventede dynamiske processer i et planteenzym.
"Vores undersøgelse giver en plan for enzymdynamik, som var utilgængelig før.
"Det betyder, at vi potentielt kan forbedre enzymets egenskaber, der er afgørende for spiring, og den måde, rødderne vokser på, hvilket fører til højere bygudbytter, hvilket er afgørende i kornproduktionen.
"Der er også en række andre områder, som denne forskning kan anvende på tværs af flere industrier og produkter.
"Dette arbejde er resultatet af otte års forskning, ikke kun fra School of Agriculture, Food and Wine og Waite Research Institute, men andre institutioner i Australien og også i Kina, Frankrig, Spanien og Thailand.
"Det har virkelig været en samarbejdsindsats, og en vi er ekstremt stolte af, især når fødevaremangel er et så kritisk og vigtigt emne rundt om i verden. Mulighederne, der stammer fra dette arbejde, er uendelige."
Enzymer er afgørende for livet. De øger markant hastigheden af en kemisk reaktion uden at undergå nogen permanent kemisk ændring i sig selv.
Men når enzymer omdannes, bevæger de stoffer, som et enzym opererer med, sig ind og ud fra enzymet med høj hastighed.
Denne proces hæmmer undersøgelsen af disse interaktioner ved hjælp af standard eksperimentelle teknikker - et problem, der blev bragt frem i lyset ved hjælp af denne multidisciplinære tilgang.
"Dette arbejde kan føre til betydelige forbedringer i katalytiske hastigheder, stabilitet og produkthæmning i disse enzymer," sagde emerita professor Hrmova.
"De nye resultater er anvendelige til at udvikle eller fremstille produkter gennem nye former for biomanipulerede enzymer, der kan anvendes uden for biologiske systemer gennem den kemiske og bioteknologiske industri." + Udforsk yderligere
Planteopdagelse åbner grænser
 Varme artikler
Varme artikler
-
 Forskere knækker opløsningsmiddelblandinger puslespilKredit:HIMS Kemikere, der arbejder ved University of Amsterdams (UvA) forskningsprioritetsområde for bæredygtig kemi, har samarbejdet med Solvay Lab of the Future i Bordeaux om at udvikle en prakt
Forskere knækker opløsningsmiddelblandinger puslespilKredit:HIMS Kemikere, der arbejder ved University of Amsterdams (UvA) forskningsprioritetsområde for bæredygtig kemi, har samarbejdet med Solvay Lab of the Future i Bordeaux om at udvikle en prakt -
 Vand kan være nøglen til at forstå sødmeKredit:American Chemical Society Et tranebær, honning eller en slikbar - hvad smager sødest? Disse fødevarer indeholder sukkerarter, som mennesker kan opfatte forskelligt. Et tranebær virker syrli
Vand kan være nøglen til at forstå sødmeKredit:American Chemical Society Et tranebær, honning eller en slikbar - hvad smager sødest? Disse fødevarer indeholder sukkerarter, som mennesker kan opfatte forskelligt. Et tranebær virker syrli -
 Sådan beregnes fortyndingsopløsningerEn fortyndingsopløsning indeholder opløst (eller stamopløsning) og et opløsningsmiddel (kaldet fortyndingsmiddel). Disse to komponenter kombineres proportionalt for at skabe en fortynding. Du kan iden
Sådan beregnes fortyndingsopløsningerEn fortyndingsopløsning indeholder opløst (eller stamopløsning) og et opløsningsmiddel (kaldet fortyndingsmiddel). Disse to komponenter kombineres proportionalt for at skabe en fortynding. Du kan iden -
 Tweaking af en molekylstruktur kan sende den ned ad en anden vej til krystallisationEn lille ændring til en peptoid, der krystalliserer i et trin (venstre), sender den modificerede peptoid ned ad en mere kompliceret vej fra uordnet klump til krystal (højre). Kredit:Jim De Yoreo/PNNL
Tweaking af en molekylstruktur kan sende den ned ad en anden vej til krystallisationEn lille ændring til en peptoid, der krystalliserer i et trin (venstre), sender den modificerede peptoid ned ad en mere kompliceret vej fra uordnet klump til krystal (højre). Kredit:Jim De Yoreo/PNNL
- Sørg for, at tømmer måler op
- Forskning afslører, hvordan vores kroppe holder uvelkomne besøgende ude af cellekerner
- Smartphone-sensor kan registrere snavset vand
- Ny undersøgelse undersøger betydningen af Tambora-udbruddet i 1816-året uden en sommer
- Hvad er vinden i en tundra?
- Sydkorea lancerer første nationale 5G -netværk - to dage for tidligt


