Forskere bestemmer aktiveringsmekanismen for G-proteinkoblede receptorer
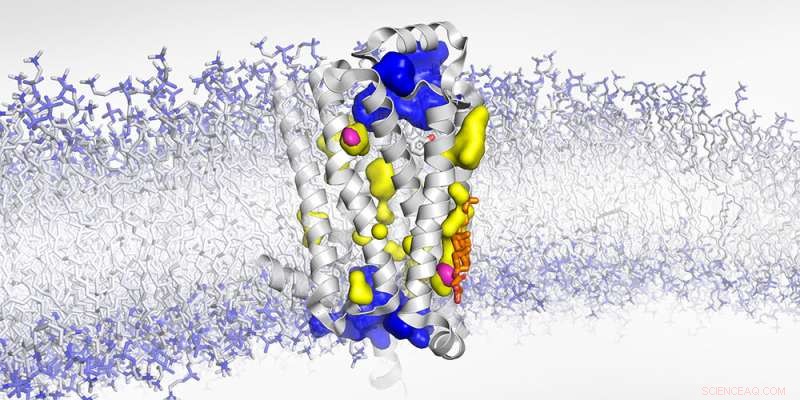
Struktur af den membranbundne β1-adrenerge receptor med vandeksponerede hulrum (blå), ikke tilgængelige for vand (gul) og tørre hulrum (magenta). Kredit:Biozentrum, Universitetet i Basel
Næsten alle vitale funktioner i den menneskelige krop reguleres af såkaldte G-protein-koblede receptorer på celleoverfladen. Disse receptorer tjener således som attraktive lægemiddelmål til behandling af forskellige sygdomme. Forskere har nu opdaget, at tomme rum inde i disse receptorer er vigtige for deres aktivering og dermed for at videresende beskeder til den indre celle. Deres tilgang til at lokalisere disse hulrum kan hjælpe med at lede eftersøgningen efter nye lægemidler.
De G-proteinkoblede receptorer (GPCR'er) gør os i stand til blandt andet at se, smage mad, føle os kolde eller varme eller reagere på stress. Placeret på celleoverfladen registrerer GPCR'er en lang række signaler såsom næringsstoffer, lys, lugte eller hormoner. Ved at ændre deres konformation overfører de denne information fra ydersiden til indersiden af cellen. Den akkumulerede viden om GPCR'er har i høj grad påvirket moderne medicin:omkring en tredjedel af alle markedsførte lægemidler retter sig mod GPCR'er.
Tomme pladser, der er vigtige for receptoraktivering
Ved hjælp af banebrydende teknologi har forskerholdet ledet af prof. Stephan Grzesiek sammen med samarbejdspartnere ved Biozentrum ved University of Basel og Paul Scherrer Institute nu opdaget, at GPCR'er indeholder helt tomme hulrum, som er vigtige for deres aktivering. Deres seneste, eksperimentelle tilgang, offentliggjort i Nature Chemistry , kan lede og fremskynde søgningen efter nye og mere specifikke lægemiddelkandidater med færre bivirkninger.
Selvom de 826 GPCR'er i den menneskelige krop reagerer på mange forskellige stimuli, deler de alle en fælles arkitektur. "Vores mål er at forstå på det atomare niveau, hvordan GPCR'er transmitterer signaler," siger Dr. Layara Abiko, som medleder undersøgelsen. "I mange år har vi derfor studeret den β1-adrenerge receptor, en GPCR, der forbereder kroppen til kamp eller flugt." Hormonet adrenalin binder sig til og aktiverer receptoren, som udløser en stressreaktion, hvilket for eksempel forårsager en stigning i hjertefrekvens og blodtryk." Betablokkere hæmmer denne receptor og er derfor effektive lægemidler til behandling af hypertension eller hjerte-kar-sygdomme.
Nøjagtig lokalisering af tørre hulrum
"Takket være højtryks-NMR og vores eksperimentelle tilgang ved hjælp af røntgenspredning på receptorkrystaller, der inkorporerede ædelgassen xenon, kunne vi yderligere fuldende billedet af denne meget dynamiske receptor," siger Abiko. "Tidligere har man antaget, at hulrummene inde i receptoren er fyldt med vand. Vi har nu afsløret, at nogle af dem er tomme." Under aktivering ændres receptorens konformation på en sådan måde, at disse tørre hulrum bliver komprimeret og forsvinder. Som følge heraf krymper receptoren ligesom når du klemmer en svamp. I tilfælde af den β1-adrenerge receptor er denne konformationsændring nøglen til at starte kroppens kamp-eller-flugt-respons.
Forskerne har nu været i stand til nøjagtigt at lokalisere to af sådanne tomme hulrum og afsløret, at kolesterol - en vigtig cellemembrankomponent - kan fylde en af disse. Som en kile forhindrer kolesterol receptoren i at klemme og ændre sig til dens fuldt aktive tilstand. "Blokering af dette tomrum blokerer de subtile, men væsentlige bevægelser, der kræves for at aktivere GPCR," forklarer Abiko. "Vi tror, denne kileeffekt kunne være endnu et lag af receptorregulering."
Nye veje til lægemiddeludvikling
Men hvorfor kan det være vigtigt at spejde efter tørre hulrum? Klassiske lægemiddelbindingssteder er ofte ens blandt GPCR-underklasser. Et lægemiddel rettet mod et sådant sted kan binde til mere end én receptor og derfor forårsage uønskede bivirkninger. I modsætning hertil adskiller de tørre hulrum sig betydeligt mellem GPCR'er, selv når de er fra samme underklasse. Dette gør dem til meget selektive lægemiddelmål.
"På denne måde kan du designe lægemidler, der er meget specifikke for én receptor," forklarer Abiko. Den udviklede nye tilgang kan lokalisere sådanne ukonventionelle lægemiddelbindingssteder, som adskiller sig stærkt mellem receptorerne. Dette kan hjælpe med screeningsprocessen for nye lægemidler, spare tid og reducere omkostningerne. + Udforsk yderligere
Udforskning af grænserne for G-proteinkoblede receptorer
 Varme artikler
Varme artikler
-
 Lys som et værktøj til syntese af komplekse molekylerBlåt lys bruges som et værktøj til syntese af komplekse molekyler kaldet β-aminosyrederivater. Kredit:AG Glorius Kemikere ved universitetet i Münster har udviklet en ny og ligetil måde at producere
Lys som et værktøj til syntese af komplekse molekylerBlåt lys bruges som et værktøj til syntese af komplekse molekyler kaldet β-aminosyrederivater. Kredit:AG Glorius Kemikere ved universitetet i Münster har udviklet en ny og ligetil måde at producere -
 Kunne vi genbruge plastikposer til fremtidens stoffer?MIT ingeniører har udviklet selvkølende stoffer fra polyethylen, almindeligvis brugt i plastikposer. De vurderer, at det nye stof kan være mere bæredygtigt end bomuld og andre almindelige tekstiler. K
Kunne vi genbruge plastikposer til fremtidens stoffer?MIT ingeniører har udviklet selvkølende stoffer fra polyethylen, almindeligvis brugt i plastikposer. De vurderer, at det nye stof kan være mere bæredygtigt end bomuld og andre almindelige tekstiler. K -
 Sætter naturens krystalsymmetri på pause for at fremme målrettet medicinleveringDrexel-forskere opdagede, at pakning af flere polymer børster på en molekylær flaskebørstepolymer får den til at bøje, som er grundlaget for sfærisk krystalvækst. Kredit:Drexel University Fra snef
Sætter naturens krystalsymmetri på pause for at fremme målrettet medicinleveringDrexel-forskere opdagede, at pakning af flere polymer børster på en molekylær flaskebørstepolymer får den til at bøje, som er grundlaget for sfærisk krystalvækst. Kredit:Drexel University Fra snef -
 Ny strategi muliggør successiv spaltning og funktionalisering af C–C-bindinger i alkoholerSkematiske illustrationer af manganoxid til katalytisk spaltning og funktionalisering af alkoholreaktion. Kredit:He Peipei Et forskerhold ledet af prof. Dai Wen fra Dalian Institute of Chemical Phy
Ny strategi muliggør successiv spaltning og funktionalisering af C–C-bindinger i alkoholerSkematiske illustrationer af manganoxid til katalytisk spaltning og funktionalisering af alkoholreaktion. Kredit:He Peipei Et forskerhold ledet af prof. Dai Wen fra Dalian Institute of Chemical Phy
- Billede:James Webb Space Telescope lyser ud inspektion
- Bevaringsopkald på planteskole med savfisk
- Kemiske tendenser i høj termoelektrisk ydeevne bevist i pyrit-type dicalcogenider
- Sådan viser du en procentvis forøgelse mellem to numre
- Forskere lavede en lyd så højt, at den fordamper vand ved kontakt
- Havets temperaturer trofast registreret i perlemor


