Forskere biosyntetiserer anti-kræftforbindelse fundet i giftige australske træer

Stinging Tree i det nordlige Queensland. Kredit:Rainer Wunderlich, CC BY-SA 3.0
Det australske stikkende træ (Dendrocnide moroides) er en plante, som mange mennesker undgår for enhver pris. Træet, som er medlem af nældefamilien, er dækket af tynde siliciumnåle med et af naturens mest ulidelige toksiner, en forbindelse kaldet moroidin. "Det er berygtet for at forårsage ekstrem smerte, som varer ved i meget lang tid," sagde Whitehead Institute-medlem Jing-Ke Weng.
Der er dog en anden side af moroidin; udover at forårsage smerte, binder stoffet sig til cellernes cytoskeletter og forhindrer dem i at dele sig, hvilket gør moroidin til en lovende kandidat til kemoterapi.
At høste nok af kemikaliet til at studere har vist sig vanskeligt af indlysende årsager. Nu, i et papir offentliggjort den 19. april i Journal of the American Chemical Society , Weng, som også er lektor i biologi ved Massachusetts Institute of Technology (MIT) og tidligere postdoc Roland Kersten, nu adjunkt ved University of Michigan College of Pharmacy, præsenterer den første offentliggjorte metode til at biosyntetisere moroidin i vævene af harmløse planter såsom tobak, hvilket letter forskning i forbindelsens anvendelighed til kræftbehandlinger.
At tage et blad ud af planternes bog for at skabe peptider
Moroidin er et bicyklisk peptid - en type molekyle, der består af byggesten kaldet aminosyrer og cirkulært til at indeholde to forbundne ringe. For syntetiske kemikere har moroidin vist sig næsten umuligt at syntetisere på grund af dets komplekse kemiske struktur. Weng og Kersten ville grave dybere ned i, hvilke metoder planterne brugte til at skabe dette molekyle.
I planteceller er cykliske peptider lavet af specifikke precursorproteiner syntetiseret af ribosomet, den makromolekylære maskine, der producerer proteiner ved at oversætte messenger-RNA'er. Efter at have forladt ribosomet, behandles disse forstadieproteiner yderligere af andre enzymer i cellen for at give anledning til de endelige cykliske peptider. I 2018 havde Weng og Kersten belyst den biosyntesemekanisme af en anden type plantepeptider kaldet lyciuminer, som først blev fundet i gojibærplanten, hvilket gav dem et indblik i, hvordan post-translationelle modifikationer kan spille en rolle i at skabe forskellige typer plantepeptider kemi. "Vi lærte meget om de vigtigste elementer i dette system ved at studere lyciuminer," sagde Weng.
Da de begyndte at undersøge, hvordan moroidin blev syntetiseret, fandt forskerne, at et par andre planter, såsom Kerria japonica og Celosia argentea, også producerer peptider med lignende kemi som moroidin. "Det gav os virkelig den meget kritiske indsigt, at dette er en ny klasse af peptider," sagde Weng.
Weng og Kersten har tidligere erfaret, at BURP-domænet, som er en del af forløberproteinerne for lyciuminer og flere andre plantecykliske peptider, katalyserer nøglereaktioner involveret i peptidringdannelsen. De fandt ud af, at BURP-domænet var til stede i forløberproteinerne for moroidiner i Kerria japonica, og det så ud til at være essentielt for at skabe to-ringstrukturen af molekylerne. BURP-domænet skaber ringkemi i nærvær af kobber, og da forskerne inkuberede moroidin-precursorproteinet med kobberchlorid i laboratoriet sammen med andre nedstrøms proteolytiske enzymer, var de i stand til at skabe moroidin-lignende peptider.
Med denne information var de i stand til at producere en række moroidinanaloger i tobaksplanter ved transgent at udtrykke moroidin-precursorgenet fra Kerria japonica og variere kernemotivsekvensen svarende til moroidinpeptider. "Vi viser, at du kan producere den samme moroidin-kemi i en anden værtsplante," sagde Weng. "Tobak i sig selv er lettere at dyrke i stor skala, og vi tror også, at vi i fremtiden kan udlede en plantecellelinje fra de eksisterende tobakscellelinjer, som vi putter i moroidin-precursor-peptidet, så kan vi bruge cellelinjen til at producere molekylet, hvilket virkelig gør os i stand til at skalere op til medicinproduktion."
Fremtidig brug af moroidin
Moroidins anti-cancer egenskab skyldes, i det mindste delvist, forbindelsens unikke struktur, der gør det muligt for det at binde til et protein kaldet tubulin. Tubulin danner et skeletsystem for levende celler og giver midlerne, hvormed celler adskiller deres kromosomer, når de forbereder sig på at dele sig. I øjeblikket virker to eksisterende lægemidler mod kræft, vincristin og paclitaxel, ved at binde tubulin. Disse to forbindelser stammer også fra planter (henholdsvis Madagaskar-periwinkle og Pacific taks).
I deres nye arbejde syntetiserede Weng og Kersten en moroidinanalog kaldet celogentin C. De testede dens anti-kræftaktivitet mod en human lungekræftcellelinje og fandt ud af, at forbindelsen var giftig for kræftcellerne. Deres nye undersøgelse foreslår også potentielt nye anti-cancer-mekanismer, der er specifikke for denne lungekræftcellelinje ud over tubulinhæmning.
Tidligere er forskere stødt ind i problemer, når de forsøger at skabe effektive lægemidler ud fra peptider. "Der er to store udfordringer for peptider som medicin," sagde Weng. "For det første er de ikke særlig stabile in vivo, og for det andet er de ikke særlig biotilgængelige og passerer ikke uden videre membranen i en celle."
Men cykliske peptider som moroidin og dets analoger er lidt anderledes. "Disse peptider udvikler sig i det væsentlige til at være lægemiddellignende," sagde Weng. "I tilfældet med det australske stikkende træ er peptiderne til stede, fordi planterne ønsker at afskrække alle dyr, der ønsker at spise bladene. Så over millioner af års evolution fandt disse planter til sidst ud af en måde at konstruere disse specifikke cykliske peptider, som er stabile, biotilgængelige og kan komme til det dyr, der forsøger at spise planterne."
Det er sandsynligt, at den smertefulde reaktion, der opstår, når moroidin kommer ind i kroppen gennem et stik fra træet, ikke ville være et problem i traditionelle metoder til administration af kemoterapi. "Smerten er virkelig forårsaget, hvis du får injektioner af forbindelsen i huden," sagde Weng. "Hvis du tager det oralt eller intravenøst, vil din krop højst sandsynligt ikke mærke smerten."
Lidt kontraintuitivt kunne forbindelsen også bruges som smertestillende. "Hvis noget forårsager smerte, kan du nogle gange bruge det som en smertestillende medicin," sagde Weng. "Du kan i det væsentlige udmatte smertereceptorerne, eller hvis du ændrer strukturen en lille smule, kan du forvandle en agonist til en antagonist og potentielt blokere smerten."
På et mere grundlæggende niveau kunne moroidin hjælpe forskere med at studere smertereceptorer. "Vi ved ikke præcis, hvorfor det at blive stukket af det stikkende træ producerer den enorme mængde smerte, og der kan være yderligere smertereceptorer, som folk ikke har identificeret," sagde Weng. "At være i stand til at syntetisere moroidin giver en kemisk sonde, der giver os mulighed for at studere denne ukendte smerteopfattelse hos mennesker."
I fremtiden håber forskerne at skabe analoger af moroidin til undersøgelse og forhåbentlig skabe en optimal version til brug i kræftbehandling. "Vi ønsker at generere et bibliotek af moroidin-lignende peptider," sagde Weng. "Vi har gjort dette for lyciuminer, og da de oprindelige moroidiner er anti-tubulin-molekyler, kan vi bruge dette system til at finde en forbedret version, der binder til tubulin endnu tættere og indeholder andre farmakologiske egenskaber, der gør det egnet til at blive brugt som et terapeutisk middel. + Udforsk yderligere
Screening for makrocykliske peptider
 Varme artikler
Varme artikler
-
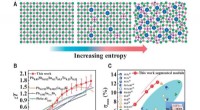 Højentropi-stabiliserede chalcogenider med høj termoelektrisk ydeevneForbedring af ydeevnen af termoelektriske materialer og moduler gennem entropiteknik. (A) Diagram over gitterforvrængning med stigende entropi. Den lyserøde, rød, grøn, blå, og lilla kugler repræsen
Højentropi-stabiliserede chalcogenider med høj termoelektrisk ydeevneForbedring af ydeevnen af termoelektriske materialer og moduler gennem entropiteknik. (A) Diagram over gitterforvrængning med stigende entropi. Den lyserøde, rød, grøn, blå, og lilla kugler repræsen -
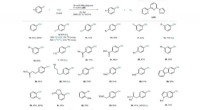 Katalytisk syntese af phenoler med dinitrogenoxidRevalorisering af N2 O som O-kilde i den katalytiske syntese af phenoler. Omfang af aryliodider. [N2 ], N2 detekteret af en gaskromatografi-termisk ledningsevnedetektor ved slutningen af reaktionen.
Katalytisk syntese af phenoler med dinitrogenoxidRevalorisering af N2 O som O-kilde i den katalytiske syntese af phenoler. Omfang af aryliodider. [N2 ], N2 detekteret af en gaskromatografi-termisk ledningsevnedetektor ved slutningen af reaktionen. -
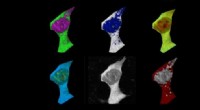 Alzheimers sygdom får celler til at overophedes og stege som ægPattedyrscelle farvet med fluorescens polymere termometre og falsk farvet baseret på temperaturgradienter. Kredit:Chyi Wei Chung Forskere har vist, at aggregering af amyloid-beta, et af to nøglepro
Alzheimers sygdom får celler til at overophedes og stege som ægPattedyrscelle farvet med fluorescens polymere termometre og falsk farvet baseret på temperaturgradienter. Kredit:Chyi Wei Chung Forskere har vist, at aggregering af amyloid-beta, et af to nøglepro -
 Ny med-tech zinksensor udvikletCNBP -forsker Dr Sabrina Heng. Kredit:CNBP En ny zinksensor er blevet udviklet af forskere, hvilket giver mulighed for en dybere forståelse af de dynamiske roller, metalioner spiller i regulering
Ny med-tech zinksensor udvikletCNBP -forsker Dr Sabrina Heng. Kredit:CNBP En ny zinksensor er blevet udviklet af forskere, hvilket giver mulighed for en dybere forståelse af de dynamiske roller, metalioner spiller i regulering
- Indien lider under det varmeste årti nogensinde
- Forskere skaber stærke, hurtig, vandtæt klæbemiddel
- Rusland kæmper for at rydde op i arktisk flodbrændstofudslip
- Diamanter fundet med guld i Canadas Far North giver ledetråde til Jordens tidlige historie
- Bank på det:Gevinster i en type kraft frembragt ved fusionsforstyrrelser opvejes af tab i en anden
- Hyperentanglement på tværs af tagplader baner vejen mod et globalt kvanteinternet


