Afsløring af en ny AAK1-hæmmer:Hvordan kemisk proteomik låser op for terapeutisk potentiale
Forbedring af lægemiddeludvikling til livstruende sygdomme som kræft afhænger af en dyb forståelse af proteinkinaser, hvilket gør det til et omdrejningspunkt for forskere. Disse enzymer, der er kodet af mere end 500 menneskelige gener, tjener som kritiske spillere i cellulære signalveje.
Men hvis disse signaler er dysregulerede, kan de forstyrre de normale cellulære mekanismer, hvilket fører til sygdomme som kræft. Proteinkinasehæmmere har derfor givet en lovende vej i terapeutisk intervention for at forstyrre de afvigende signalmekanismer, der ligger til grund for sådanne sygdomme.
På grund af ligheden og kompleksiteten af kinasestrukturer har udviklingen af effektive kinasehæmmere indtil videre været en formidabel udfordring for forskere. At finde specifikke inhibitorer blandt forskellige potentielle mål har indtil nu været en hindring.
Et hold ledet af professor Hiroshi Tokumitsu fra Graduate School of Interdisciplinary Science and Engineering in Health Systems ved Okayama University, sammen med en kandidatstuderende Ms. Akari Yoshida og Dr. Satomi Ohtsuka fra Okayama University med professor Ulf J. Nilsson fra Lunds Universitet og Professor Teruhiko Ishikawa fra Graduate School of Education ved Okayama University, offentliggjorde en undersøgelse i Scientific Reports den 20. marts 2024. Undersøgelsen kaster lys over en ny inhibitor rettet mod Adapter Protein 2-Associated Protein Kinase 1 (AAK1).
Prof. Tokumitsu siger om inspirationen:"Gennem mange års dedikeret forskning i intracellulære signalmekanismer har vi lavet proteinkinasehæmmere som potente analytiske instrumenter til grundlæggende biovidenskaber." Og nu var det tid til at se deres præstationer i aktion."
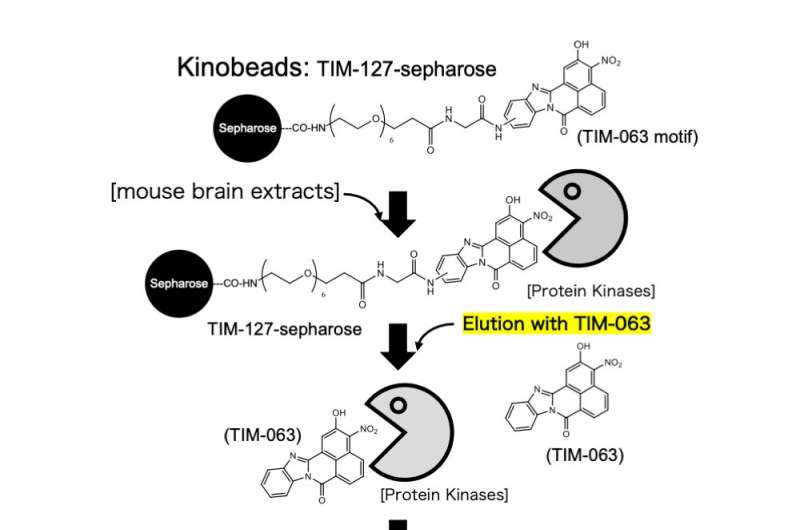
Deres undersøgelse introducerede en innovativ metode, der anvender Kinobeads-teknologi. Denne banebrydende tilgang gjorde det muligt for teamet at udforske interaktionerne mellem TIM-063, oprindeligt formuleret som en Ca 2+ /calmodulin-afhængig proteinkinase kinase (CaMKK) hæmmer og talrige proteinkinaser, med et særligt fokus på AAK1. Gennem immobilisering på sepharose-perler blev TIM-063-sepharose-komplekser skabt til selektivt at fange målkinaser fra cellulære ekstrakter.
Efter omfattende vask for at fjerne uspecifikke proteiner, blev bundne kinaser elueret og identificeret gennem massespektrometri. Denne omhyggelige tilgang kastede lys over TIM-063's binding til AAK1's katalytiske domæne og giver indsigt i dets hæmmende mekanisme. Ved at belyse bindingen af TIM-063 til AAK1's katalytiske domæne etablerede forskerne et grundlag for målrettet hæmning.
"Vores forskning fremhæver potentialet ved at genbruge eksisterende kinasehæmmere som ledende forbindelser til nye terapeutiske mål," siger prof. Tokumitsu.
"Ved at udnytte metoder til udvikling af kinasehæmmere, begyndende med at identificere enzymer, der interagerer med eksisterende inhibitorer, lover det en hurtig lægemiddelopdagelsescyklus med proteinkinaser som det molekylære mål."
Studiets fokus på AAK1, forbundet med forskellige neurologiske lidelser og virusinfektioner, fremhæver løftet om målrettede hæmmere. Disse resultater åbner døre for innovativ lægemiddeludvikling, især med hensyn til at imødekomme udækkede medicinske behov under tilstande som skizofreni, Parkinsons sygdom og virusinfektioner.
"I en tid med dyre og tidskrævende lægemidler vil vores forskning bidrage væsentligt ved at lette udviklingen af hurtige og omkostningseffektive enzymhæmmere med kliniske anvendelser," siger prof. Tokumitsu.
Dette gennembrud har potentialet til at revolutionere lægemiddelopdagelsen og tilbyde en mere strømlinet tilgang til udvikling af enzymhæmmere med reelle kliniske anvendelser. Med dette fremskridt sigter forskerne på at løse kritiske sundhedsudfordringer og forbedre patienternes velvære.
Flere oplysninger: Akari Yoshida et al., Udvikling af en ny AAK1-hæmmer via Kinobeads-baseret screening, Scientific Reports (2024). DOI:10.1038/s41598-024-57051-9
Journaloplysninger: Videnskabelige rapporter
Leveret af Okayama University
 Varme artikler
Varme artikler
-
 Forskere udvikler potentielt terapeutisk gel, som detekterer nitrogenoxid, absorberer overskydende v…IBS-forskere udviklede en hydrogel lavet af polymert akrylamid (blå spaghetti) forbundet med tværbindere (sort), som kan rumme lægemiddelmolekyler (lilla stjerner) inden for dets net (grå). I nærværel
Forskere udvikler potentielt terapeutisk gel, som detekterer nitrogenoxid, absorberer overskydende v…IBS-forskere udviklede en hydrogel lavet af polymert akrylamid (blå spaghetti) forbundet med tværbindere (sort), som kan rumme lægemiddelmolekyler (lilla stjerner) inden for dets net (grå). I nærværel -
 Forskere skaber nye materialer, der kan øge stabiliteten af perovskit-solcellerTværbindingseffekt giver modstand mod de nye forbindelser syntetiseret af litauiske kemikere. Kredit:And Unicorns En gruppe kemikere fra Kaunas University of Technology i Litauen, udviklerne af ads
Forskere skaber nye materialer, der kan øge stabiliteten af perovskit-solcellerTværbindingseffekt giver modstand mod de nye forbindelser syntetiseret af litauiske kemikere. Kredit:And Unicorns En gruppe kemikere fra Kaunas University of Technology i Litauen, udviklerne af ads -
 Et usynligt nøglehul via gennemsigtig elektronikEmpa-forsker Evgeniia Gilshtein har udviklet et usynligt nøglehul:Kredsløb er placeret på et gennemsigtigt underlag, som knapt kan opfattes for det menneskelige øje. Kredit:Empa Hårde tider for in
Et usynligt nøglehul via gennemsigtig elektronikEmpa-forsker Evgeniia Gilshtein har udviklet et usynligt nøglehul:Kredsløb er placeret på et gennemsigtigt underlag, som knapt kan opfattes for det menneskelige øje. Kredit:Empa Hårde tider for in -
 Kulstofkæder antager fusilli- eller spaghetti-former, hvis de har ulige eller lige talBilledet viser, hvordan konformationen (formen) af vores carbonkæder veksler mellem ordnede og kaotiske strukturer, da carbonkæden veksler mellem at have lige og ulige antal atomer. Kredit:University
Kulstofkæder antager fusilli- eller spaghetti-former, hvis de har ulige eller lige talBilledet viser, hvordan konformationen (formen) af vores carbonkæder veksler mellem ordnede og kaotiske strukturer, da carbonkæden veksler mellem at have lige og ulige antal atomer. Kredit:University
- Se gennem jord kan hjælpe landmændene med at håndtere fremtidige tørkeperioder
- Livet kunne være opstået fra søer med højt fosforindhold
- Undersøgelse finder, at forhistoriske mennesker spiste knoglemarv som dåsesuppe 400, 000 år siden
- Forskere udvikler metode til video-promo-klip via sporing af ansigtsudtryk
- Seksuel chikane i metaversen? Kvinde anklager for voldtægt i den virtuelle verden
- Kvantfysik:Vores undersøgelse tyder på, at objektiv virkelighed ikke eksisterer


